- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Физико-химия дисперсных систем. Коллоидные растворы
Содержание
- 2. План лекцииОбщие понятияКлассификация дисперсных системМетоды получения коллоидовМетоды очистки коллоидных растворовМолекулярно-кинетические свойства коллоидных растворов
- 3. Коллоидная химияРаздел физической химии, изучающий физико-химические свойства гетерогенных высокодисперсных систем, растворов и высокомолекулярных соединений
- 4. Немного истории…До начала XX века наука о
- 5. По Т. ГрэмуКристаллоиды – вещества быстро диффундирующие
- 6. По И.Г. БорщевуВ зависимости от условий одно
- 7. Коллоидное состояние веществаСтепень его раздробленности (дисперсности) и нахождение коллоидных частиц во взвешенном состоянии в растворителе
- 8. Удельная поверхность фазы SSуд =
- 9. Дисперсная системаДисперсионная среда – растворитель, в котором
- 10. Гетерогенные (неоднородные) системыДисперсные системы, в которых одно
- 11. Классификация дисперсных системПо величине частиц дисперсной фазыГрубодисперсные
- 12. По агрегатному состоянию
- 13. Классификация коллоидных растворовПо интенсивности взаимодействия частиц на
- 14. По текучести растворов:Золи – коллоидные растворы, имеющие
- 15. Условия получения коллоидовДисперсная фаза должна обладать плохой
- 16. Методы получения коллоидных растворовДисперсионные методы – дробление
- 17. Дисперсионные методыМеханические (шаровые и коллоидные мельницы, ступка)
- 18. Пептизация – процесс перехода вещества из осадка
- 19. Конденсационные методыОкисление2H2S + O2 → 2H2O +
- 20. НейтрализацияCa(OH)2 + H2SO4 → CaSO4 + 2H2OЗамена
- 21. Методы очистки коллоидных растворовДиализ – основан на
- 22. Молекулярно-кинетические свойства коллоидных растворовСедиментационное равновесиеБроуновское движениеДиффузияОсмотическое давление
- 23. Седиментационное равновесие 2
- 24. h – высота, на которую нужно подняться,
- 25. Применение седиментационного анализаОпределение размера и фракционного состава
- 26. Броуновское движениеПрисуще частицам с размерами не более
- 27. Уравнение Эйнштейна-СмолуховскогоОписывает броуновское движениеΔх = √2Дτ τ
- 28. Диффузия ΔCΔm = -Д · ----- ·
- 29. Осмотическое давлениеОсмотическое давление коллоидных растворов подчиняется закону
- 30. πосм (1% золь золота) = 0,00045 атмπосм
- 31. Скачать презентацию
- 32. Похожие презентации
План лекцииОбщие понятияКлассификация дисперсных системМетоды получения коллоидовМетоды очистки коллоидных растворовМолекулярно-кинетические свойства коллоидных растворов






























Слайд 2
План лекции
Общие понятия
Классификация дисперсных систем
Методы получения коллоидов
Методы очистки
коллоидных растворов
Слайд 3
Коллоидная химия
Раздел физической химии, изучающий физико-химические свойства гетерогенных
высокодисперсных систем, растворов и высокомолекулярных соединений
Слайд 4
Немного истории…
До начала XX века наука о коллоидах
содержала описание свойств отдельных высокодисперсных систем и способы их
приготовленияМ.В. Ломоносов, Ловиц, Рейсс, Ф.Сельми, М.Фарадей – внесли неоценимый вклад в развитие коллоидной химии
Томас Грэм (1861) – «отец» коллоидной химии; ввел термин и определил понятие «коллоиды»
Слайд 5
По Т. Грэму
Кристаллоиды – вещества быстро диффундирующие и
проходящие через растительные и животные мембраны, легко кристаллизующиеся
Растворы кристаллоидов
– истинные растворыКоллоиды – вещества, обладающие очень малой диффузией, не проходящие через мембраны и не кристаллизующиеся, а образующие аморфные осадки
Растворы коллоидов – золи
Слайд 6
По И.Г. Борщеву
В зависимости от условий одно и
то же вещество может проявлять свойства кристаллической и коллоидной
формР-р NaCl в воде – истинный раствор,
Р-р NaCl в бензоле – коллодный
Мыло в воде – коллоид
Мыло в спирте – кристаллоид
Можно говорить лишь о коллоидном и кристаллоидном состоянии того или иного вещества
Слайд 7
Коллоидное состояние вещества
Степень его раздробленности (дисперсности) и нахождение
коллоидных частиц во взвешенном состоянии в растворителе
Слайд 8
Удельная поверхность фазы
S
Sуд = -----
V
S – суммарная поверхность всех частиц
V –
объем вещества, подвергающегося дроблению
Слайд 9
Дисперсная система
Дисперсионная среда – растворитель, в котором распределено
вещество в раздробленном состоянии
Дисперсная фаза – раздробленное вещество
Между дисперсной
фазой и дисперсионной средой существует поверхность раздела
Слайд 10
Гетерогенные (неоднородные) системы
Дисперсные системы, в которых одно вещество
распределено в другом в виде частиц различных размеров
Во многом
близки к коллоидно-дисперсным системам грубодисперсные суспензии, эмульсии и пены
Слайд 11
Классификация дисперсных систем
По величине частиц дисперсной фазы
Грубодисперсные (больше
10-7м). Быстро оседают, видимы в микроскоп, остаются на бумажном
фильтре, неустойчивы (суспензии, эмульсии, взвеси)Коллоидно-дисперсные (10-7-10-9м). Относительно устойчивы
Молекулярно- и ионно-дисперсные. Гомогенны, устойчивы (истинные растворы)
Слайд 13
Классификация коллоидных растворов
По интенсивности взаимодействия частиц на поверхности
раздела фаз:
Лиофильные – сильное взаимодействие; устойчивы, обратимы (взаимодействие полярных
групп веществ с полярными жидкостями или неполярных групп с неполярными жидкостями)Лиофобные – взаимодействие частиц только при добавлении стабилизаторов; необратимы (металлы в коллоидном состоянии, эмульсии)
Слайд 14
По текучести растворов:
Золи – коллоидные растворы, имеющие текучесть
(свободнодисперсные)
Гели – коллоидные растворы, утратившие текучесть (связанно-дисперсные – существуют
устойчивые связи между частицами дисперсной фазы)
Слайд 15
Условия получения коллоидов
Дисперсная фаза должна обладать плохой растворимостью
Размеры
диспергируемого вещества должны быть доведены до размеров коллоидных частиц
(10-7-10-9м)Необходимы стабилизаторы, которые на поверхности раздела фаз образуют ионный или молекулярный слой и гидратную оболочку
Слайд 16
Методы получения коллоидных растворов
Дисперсионные методы – дробление вещества
до коллоидной степени дисперсности
Конденсационные методы – укрупнение молекул и
ионов до размеров коллоидных частиц
Слайд 17
Дисперсионные методы
Механические (шаровые и коллоидные мельницы, ступка) –
диспергирование с добавлением стабилизаторов
Ультразвуковые – диспергирование частиц под действием
сжатий и расширенийСлайд 18 Пептизация – процесс перехода вещества из осадка в
золь при добавлении диспергирующих веществ (Al(OH)3, Fe(OH)3 + электролит)
Растворение
– самопроизвольное диспергирование (желатин, крахмал, агар-агар)Электрическое диспергирование – материал электродов испаряется при температуре электрической дуги и конденсируется в частицы коллоидных размеров
Слайд 19
Конденсационные методы
Окисление
2H2S + O2 → 2H2O + 2S↓
Восстановление
Ag2O
+ H2 → 2Ag0 + H2O
Реакции обмена
BaCl2 + K2SO4
→ BaSO4 + 2KClГидролиз
FeCl3 + 3H2O → Fe(OH)3 + 3HCl
Fe(OH)3 + HCl → FeOCl + 2H2O
FeOCl → FeO+ + Cl-
Слайд 20
Нейтрализация
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O
Замена растворителя
При
вливании спиртовых растворов серы, канифоли, в воду, в которой
эти вещества плохо растворимы, они начинают конденсироваться в частицы коллоидных размеров и могут находиться во взвешенном состоянии
Слайд 21
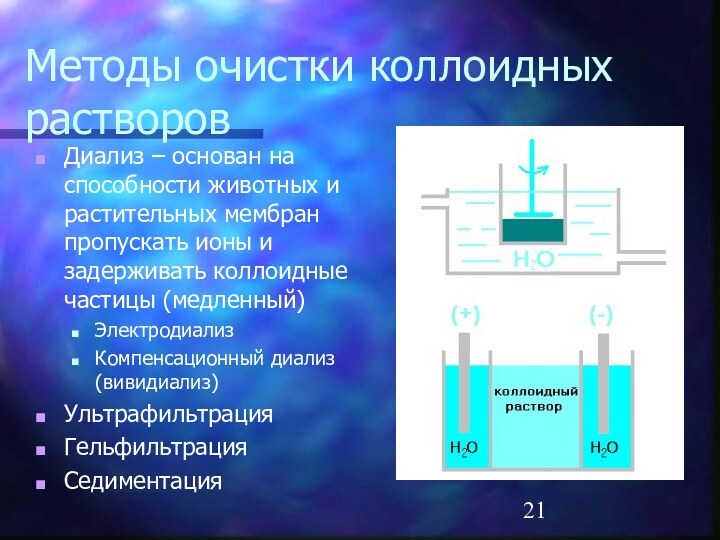
Методы очистки коллоидных растворов
Диализ – основан на способности
животных и растительных мембран пропускать ионы и задерживать коллоидные
частицы (медленный)Электродиализ
Компенсационный диализ (вивидиализ)
Ультрафильтрация
Гельфильтрация
Седиментация
Слайд 22
Молекулярно-кинетические свойства коллоидных растворов
Седиментационное равновесие
Броуновское движение
Диффузия
Осмотическое давление
Слайд 23
Седиментационное равновесие
2
(d – d0)
υ = ---- · r2g · ----------,
см/с9 η
Характеризуется:
Равенством скоростей седиментации и диффузии
Постепенным уменьшением концентрации частиц в направлении от нижних слоев к верхним
Слайд 24 h – высота, на которую нужно подняться, чтобы
давление упало вдвое
Изменение концентрации с высотой будет тем больше,
чем больше масса частиц
Слайд 25
Применение седиментационного анализа
Определение размера и фракционного состава частиц
(число частиц разного размера)
Определение молекулярного веса полимерных материалов, белков,
нуклеиновых кислотКачественная оценка функционального состояния эритроцитов. СОЭ значительно меняется при различных заболеваниях
Слайд 26
Броуновское движение
Присуще частицам с размерами не более 10-6м
Не
зависит от природы вещества
Обусловлено тепловым движением молекул
Изменяется в зависимости
от температуры, вязкости среды и размеров частиц
Слайд 27
Уравнение Эйнштейна-Смолуховского
Описывает броуновское движение
Δх = √2Дτ
τ –
время
Δх – среднее смещение (среднее расстояние, на которое сместится
коллоидная частица в единицу времени)Д – коэффициент диффузии
Слайд 28
Диффузия
ΔC
Δm = -Д · ----- · Δτ
ΔX
Скорость диффузии в случае коллоидных растворов во много раз
меньше, чем в истинных (т.к. коллоидные частицы обладают большим размером и массой, чем отдельные молекулы или ионы)
Слайд 29
Осмотическое давление
Осмотическое давление коллоидных растворов подчиняется закону Вант-Гоффа
πосм
= КБ · СV · T
СV – частичная
концентрацияmдф
СV = ---------
mч · V
Как правило, в 1 000 раз меньше осмотического давления истинных растворов
Слайд 30
πосм (1% золь золота) = 0,00045 атм
πосм (1%
раствор сахарозы) = 0,725 атм
Осмотическое давление коллоидных растворов со
временем уменьшается (частицы самоукрупняются или оседают, и их в растворе становится меньше)Часть измеряемого осмотического давления в коллоидных растворах обусловлена примесью электролитов