для полного сгорания 10,8 г алюминия
m(Al)
n(Al)
M(Al)
V(O2)
n(O2)
Vm
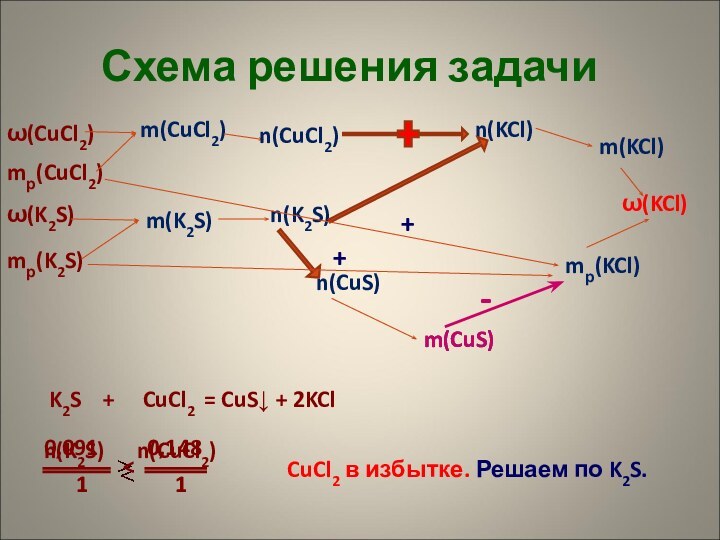
Дано:
m(Al) = 10,8 г
V(O2) = ?
Сравнить
по уравнению
n =
m
M
n =
V
Vm
4Al + 3O2 = 2Al2O3