- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Основные виды химической связи
Содержание
- 3. Радиус атома увеличивается в ряду:Be, Mg, CaI, Br, ClB, C, NN, P, S
- 4. Химическая связь – это силы взаимодействия, которые соединяют отдельные атомы в молекулы, ионы, кристаллы.
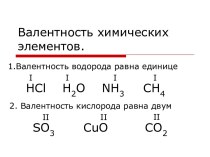
- 5. Химическая связь образуется:1) между атомами металлов и
- 7. Химическую связь, возникшую в результате образования общих (связывающих) электронных пар, называют ковалентной связью.
- 8. Ковалентная неполярная связь (КНС)Ковалентную химическую связь, которая
- 10. Ковалентная полярная связь (КПС)Химическую связь, образованную атомами,
- 12. Задание Из нижеприведённых формул веществ выпишите формулы соединений с ковалентной неполярной связью: СO2, PH3,H2, OF2, O2, CuO, NH3
- 13. Ионная связьИоны – это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
- 15. Среди перечисленных элементов максимальный радиус атома имеетХлорМагнийНатрийАлюминий
- 16. Какая химическая связь образуется между атомами:H и
- 17. Скачать презентацию
- 18. Похожие презентации
Радиус атома увеличивается в ряду:Be, Mg, CaI, Br, ClB, C, NN, P, S

















Слайд 4 Химическая связь – это силы взаимодействия, которые соединяют
отдельные атомы в молекулы, ионы, кристаллы.
Слайд 5
Химическая связь образуется:
1) между атомами металлов и неметаллов,
электроотрицательность которых одинакова.
2) между атомами элементов, электроотрицательность которых не
сильно отличается.3) между атомами элементов, электроотрицательность которых сильно отличается.