- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Периодический закон 10-11 кл.
Содержание
- 2. 1. КЕМ И КОГДА ОТКРЫТ ЗАКОН?Д. И. Менделеевым в 1869 году.
- 5. 2. ФОРМУЛИРОВКА ЗАКОНА, ДАННАЯ МЕНДЕЛЕЕВЫМ.1871
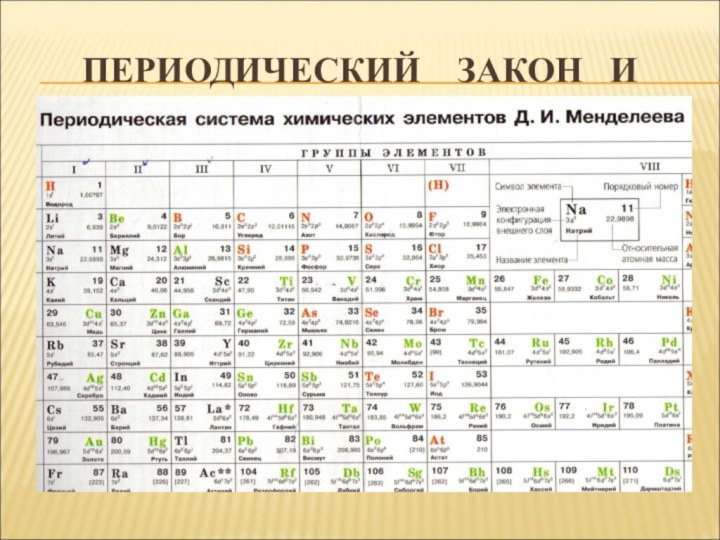
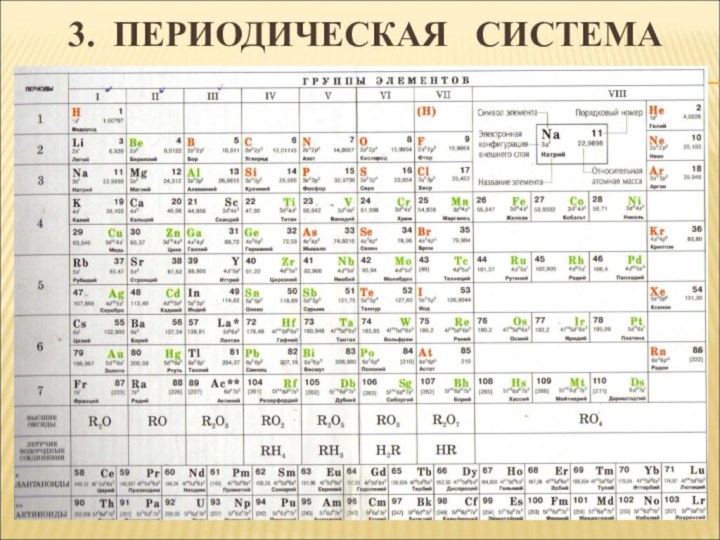
- 6. 3. ПЕРИОДИЧЕСКАЯ СИСТЕМАГрафическое выражение периодического закона.
- 7. 3. ПЕРИОДИЧЕСКАЯ СИСТЕМА
- 8. 3. ПЕРИОДИЧЕСКАЯ СИСТЕМА
- 9. 3. ПЕРИОДИЧЕСКАЯ СИСТЕМАЭлементы, атомы которых легко
- 10. 3. ПЕРИОДИЧЕСКАЯ СИСТЕМАЭлементы, атомы которых принимают
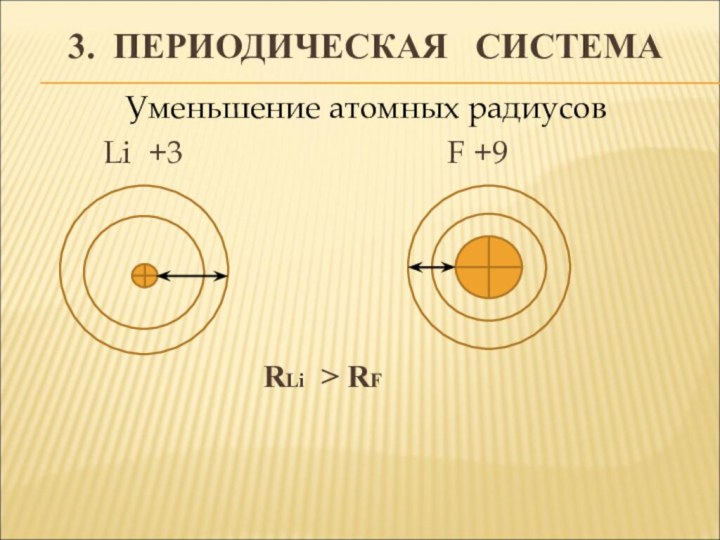
- 11. 3. ПЕРИОДИЧЕСКАЯ СИСТЕМАУменьшение атомных радиусов
- 12. ИЗМЕНЕНИЕ ВЫСШЕЙ СТЕПЕНИ ОКИСЛЕНИЯ АТОМОВ В
- 13. ГИДРОКСИДЫ ЭЛЕМЕНТОВ ТРЕТЬЕГО ПЕРИОДА Na2O
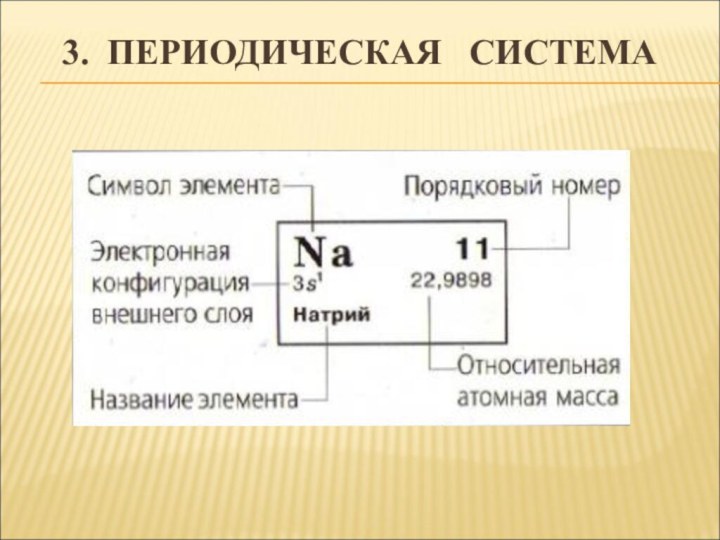
- 14. ДРУГИЕ ДАННЫЕ ТАБЛИЦЫПорядковый номер –
- 15. 4. СОВРЕМЕННАЯ ФОРМУЛИРОВКА ПЕРИОДИЧЕСКОГО ЗАКОНА:
- 16. 5. ЗНАЧЕНИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА1.
- 17. 5. ЗНАЧЕНИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА-
- 18. Скачать презентацию
- 19. Похожие презентации
1. КЕМ И КОГДА ОТКРЫТ ЗАКОН?Д. И. Менделеевым в 1869 году.














Слайд 5
2. ФОРМУЛИРОВКА ЗАКОНА, ДАННАЯ МЕНДЕЛЕЕВЫМ.
1871 год
– Д.И. Менделеев сформулировал открытый им закон:
Свойства
элементов, а также их простых и сложных соединений находятся в периодической зависимости от величины весов элементов.
Слайд 9
3. ПЕРИОДИЧЕСКАЯ СИСТЕМА
Элементы, атомы которых легко отдают
ē для получения завершённого электронного уровня называются металлами.
Na + 11 Mg + 12
2ē 8ē 1ē 2ē 8ē 2ē
Слайд 10
3. ПЕРИОДИЧЕСКАЯ СИСТЕМА
Элементы, атомы которых принимают ē
для завершения электронного уровня называются неметаллами
Cl + 17 2ē 8ē 7ē
Слайд 12 ИЗМЕНЕНИЕ ВЫСШЕЙ СТЕПЕНИ ОКИСЛЕНИЯ АТОМОВ В СОЕДИНЕНИЯХ
ЭЛЕМЕНТОВ ТРЕТЬЕГО ПЕРИОДА
1+
2+ 3+ 4+ 5+ 6+ 7+Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7
Основные Амфот. Кислотные оксиды оксиды оксид
Слайд 13
ГИДРОКСИДЫ ЭЛЕМЕНТОВ ТРЕТЬЕГО ПЕРИОДА
Na2O +
H2O = 2NaOH – щёлочь
MgO + H2O =
Mg(OH)2 – основаниеAl2O3 + 3H2O = 2Al(OH)3 – амфот. гидроксид
SiO2 + H2O = H2SiO3 – самая слабая кислота
P2O5 + 3H2O = 2H3PO4 – средняя кислота
SO3 + H2O = H2SO4 – сильная кислота
Cl2O7 + H2O = 2HClO4 – самая сильная кислота
Слайд 14
ДРУГИЕ ДАННЫЕ ТАБЛИЦЫ
Порядковый номер –
Номер
периода –
Номер группы, особенно для элементов главной п/группы
– Заряд ядра атома элемента и количество электронов на уровнях.
Количество энергетических уровней.
Число электронов на внешнем уровне
Слайд 15
4. СОВРЕМЕННАЯ ФОРМУЛИРОВКА ПЕРИОДИЧЕСКОГО ЗАКОНА:
Свойства химических элементов и образуемых ими простых и сложных
веществ находятся в периодической зависимости от заряда ядра атомов этих элементов.
Слайд 16
5. ЗНАЧЕНИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА
1. Закон
объяснил уже известные научные факты.
2. С его помощью удалось
предсказать существование новых элементов, свойства которых были уже известны на основе закона.3. Закон был подтверждён другими более поздними открытиями:
Слайд 17
5. ЗНАЧЕНИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА
- Теория
строения атомов уточнила формулировку ПЗ и более глубоко раскрыла
его сущность.- Определение закономерностей размещения ē по энергетическим уровням выявило сущность периодичности:
с возрастанием заряда ядра атомов периодически повторяются сходные свойства элементов, атомы которых имеют одинаковое число валентных электронов.





























