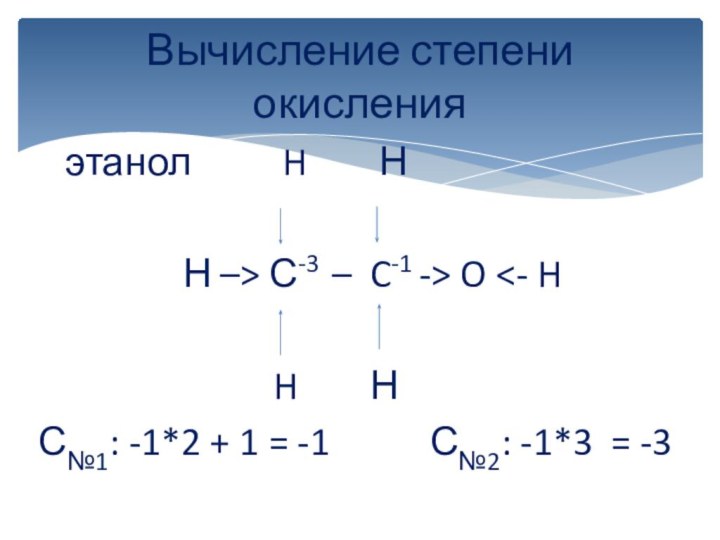
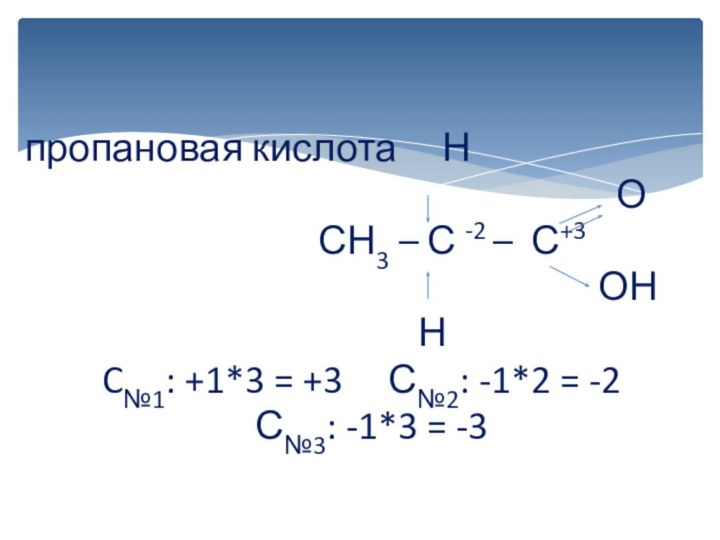
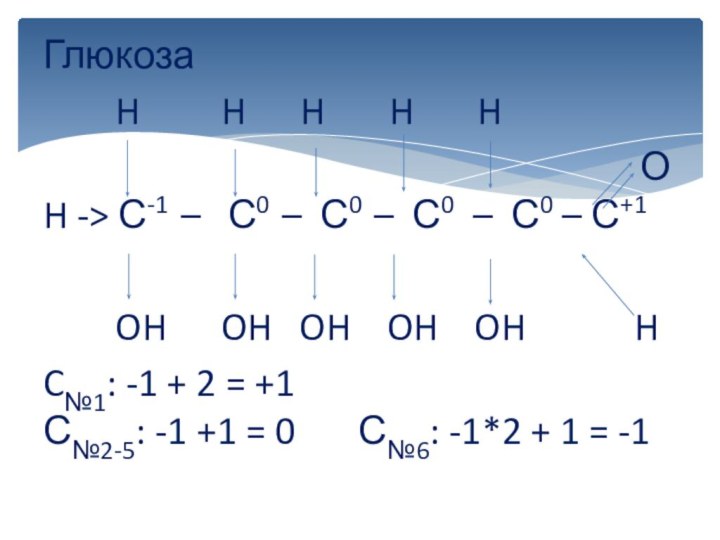
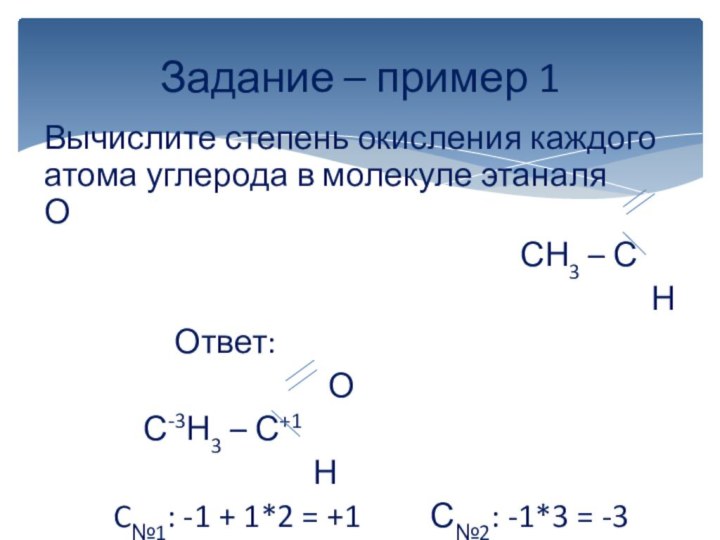
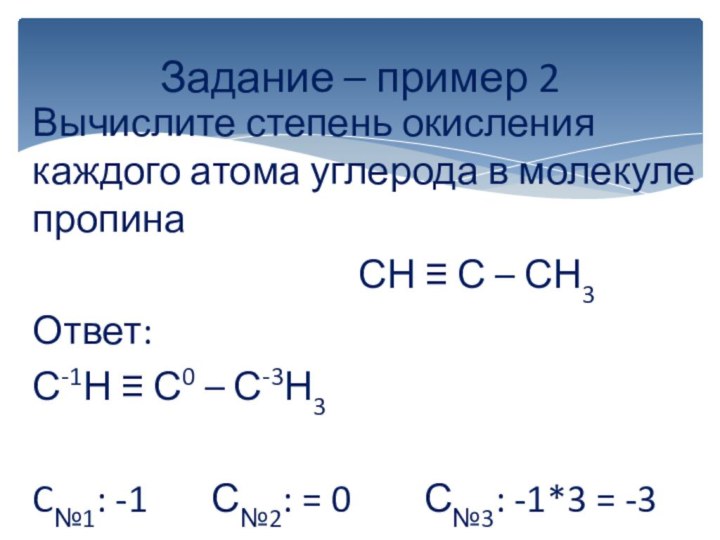
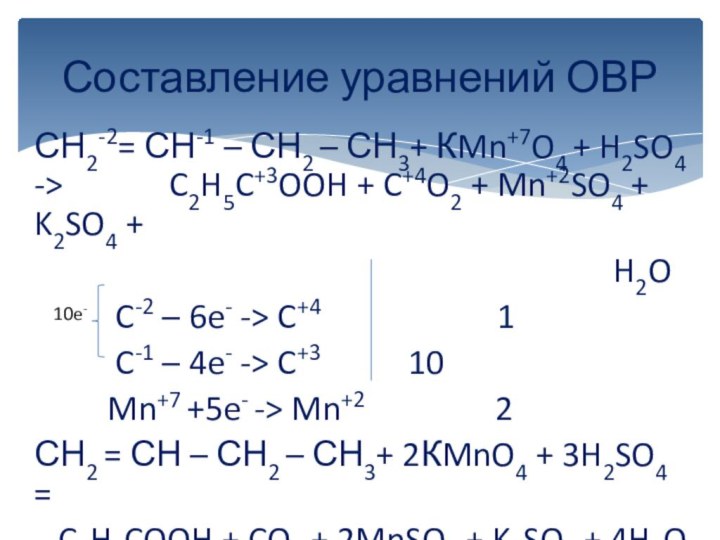
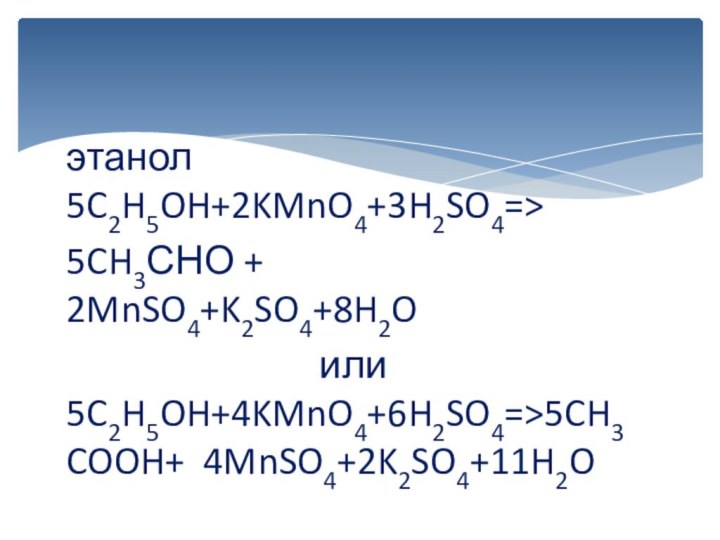
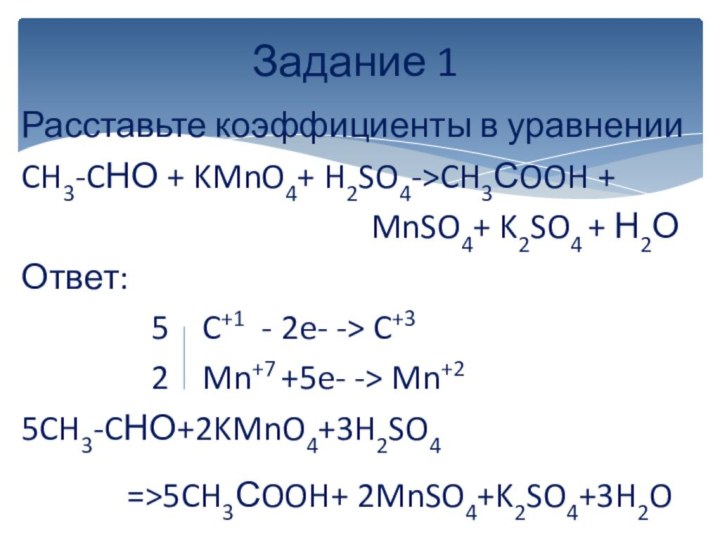
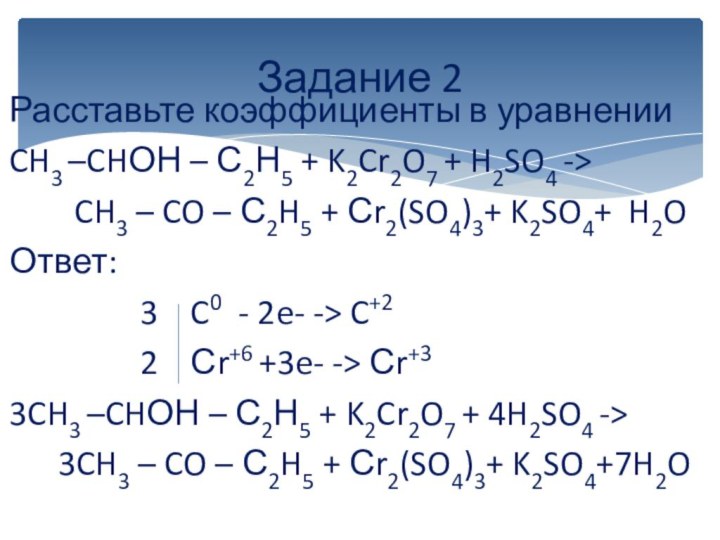
вычисляется отдельно, используя структурные формулы веществ. СО любого атома
углерода равна алгебраической сумме всех его связей с более электроотрицательным элементом (Cl,O,S,N, и др.), учитываемых со знаком «+», и связей с атомами водорода (или другого более электроположительного элемента), учитываемых со знаком «-». Связи с соседними атомами углерода не учитываются. Алгебраическая сумма всех положительных и отрицательных степеней окисления должна быть равна нулю.Степень окисления