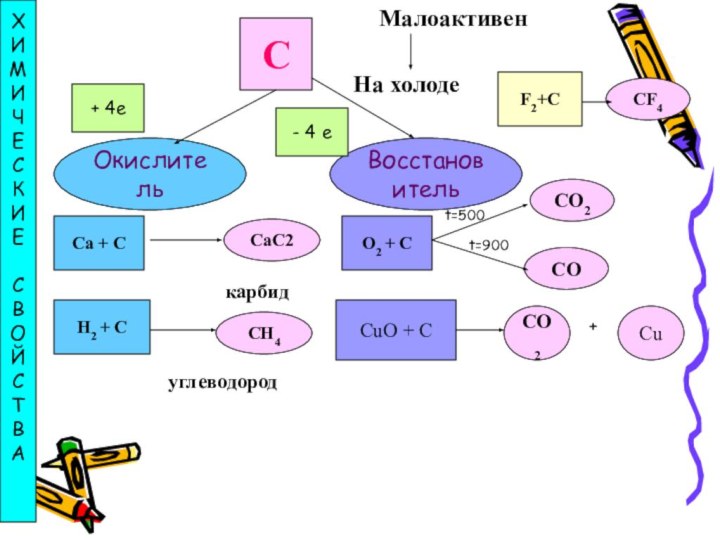
составлять схемы строения атома, аллотропии и его биологической роли,
формирование умений решения задач.
Вопрос :
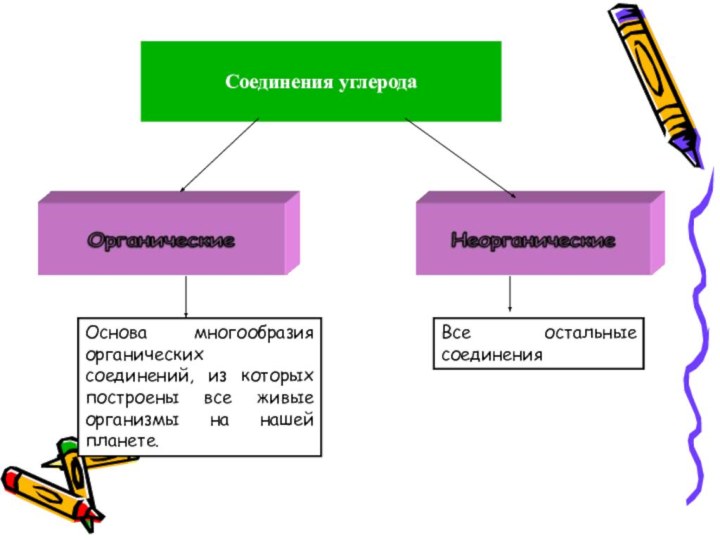
1. Почему на основе углерода строиться жизнь?
2. Почему углерод стал «началом вех начал» ?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть











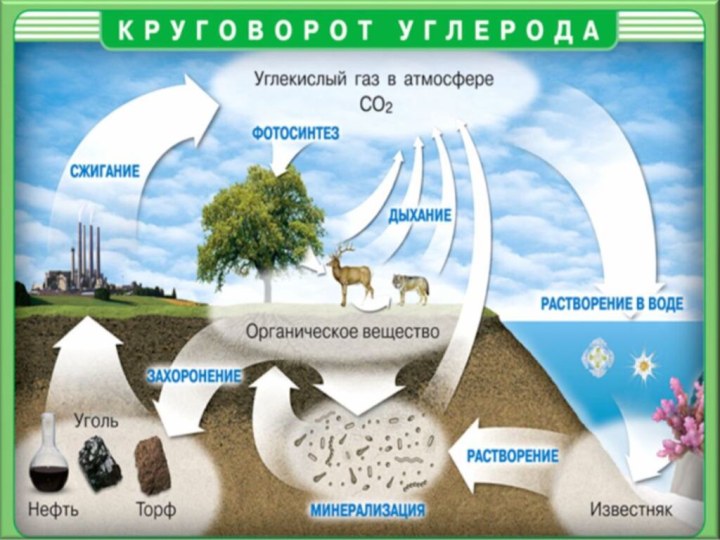





Вопрос :
1. Почему на основе углерода строиться жизнь?
2. Почему углерод стал «началом вех начал» ?
IV
II
Куллинан
Эксельсиор
Орлов
Хоуп
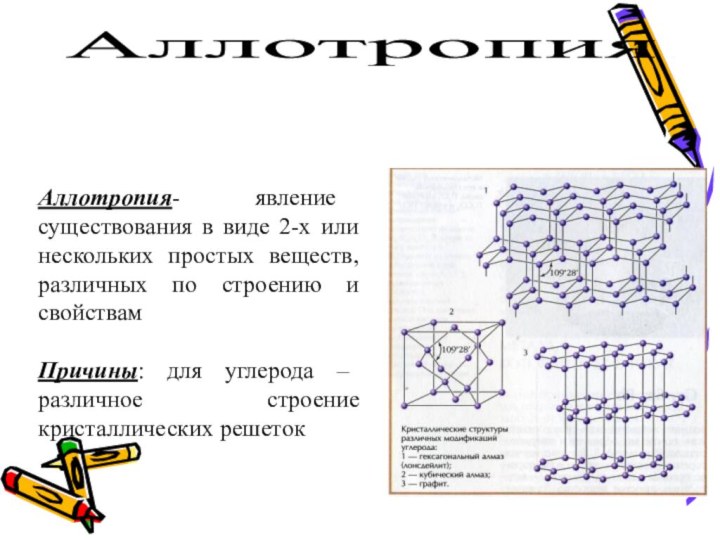
а – модель строения алмаза
б – модель строения графита
Н. Д. Зелинский
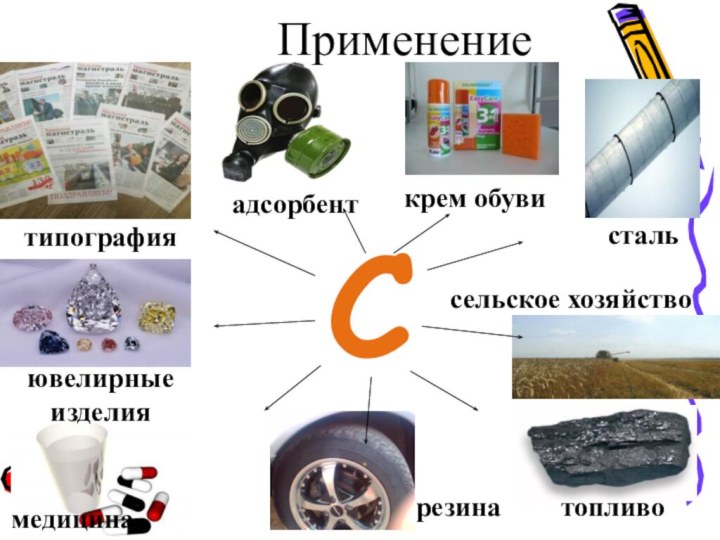
Н. Д. Зелинский разработал противогаз, который спас множество солдат в первой мировой войне. Так же применяется в медицине, химической, фармацевтической и пищевой промышленностях