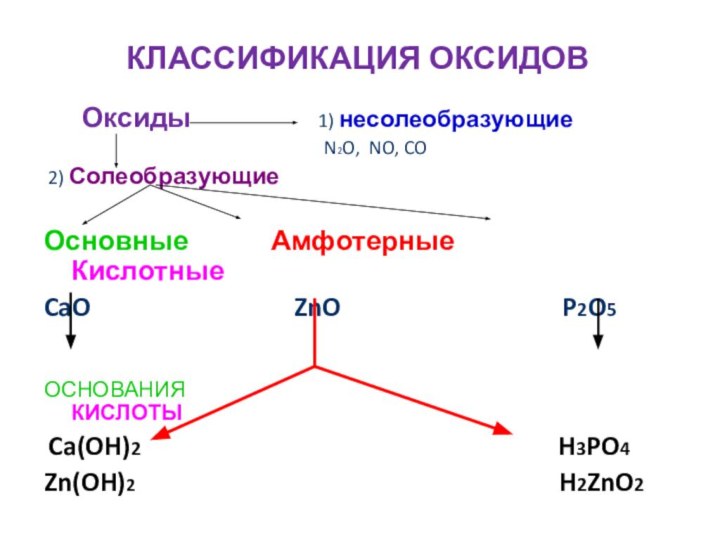
1) несолеобразующие
N2O, NO, CO
2) Солеобразующие
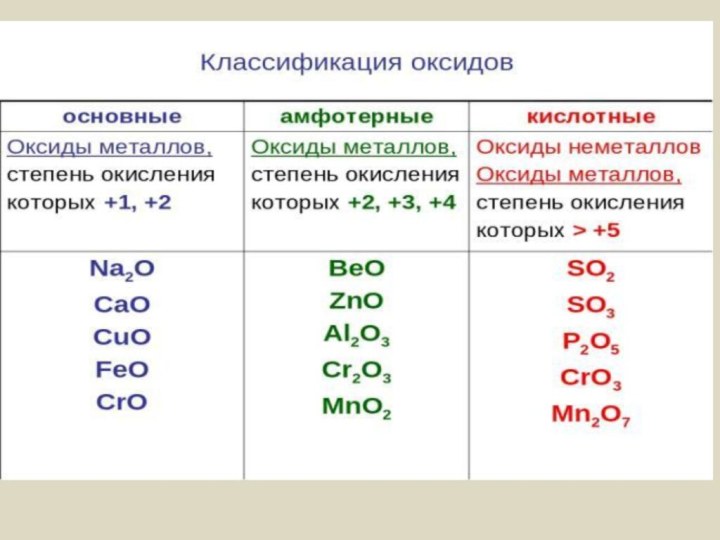
Основные Амфотерные Кислотные
CaO ZnO P2O5
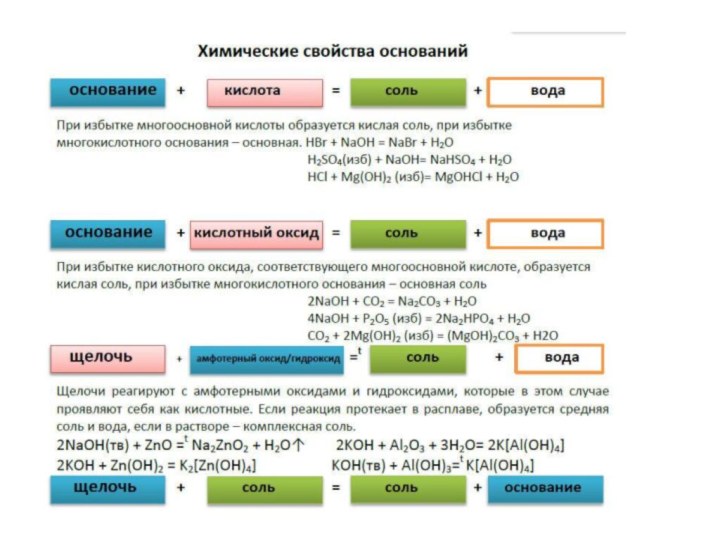
ОСНОВАНИЯ КИСЛОТЫ
Ca(OH)2 H3PO4
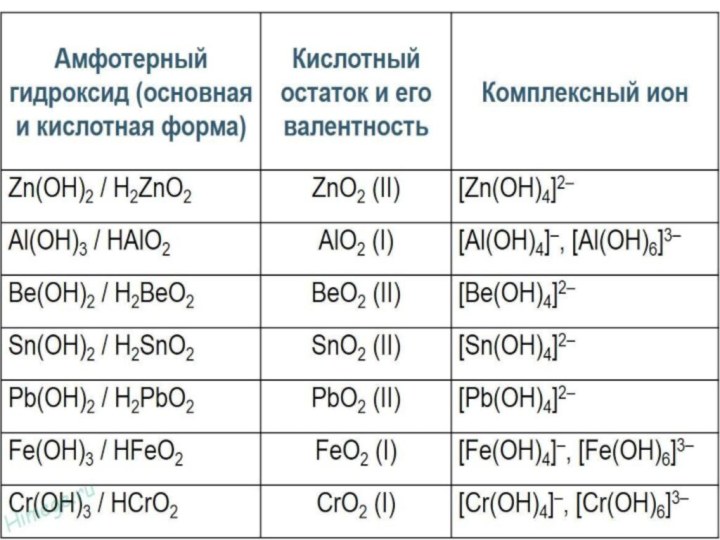
Zn(OH)2 H2ZnO2
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть







![Кислотно-основные свойства (Повторение 9 кл) Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4], Al2O3 + 2NaOH = 2NaAlO2 + H2O.t0](/img/tmb/6/570055/1dc3e6a9a3037833d9a7a6ad3a8881bc-720x.jpg)


to
to
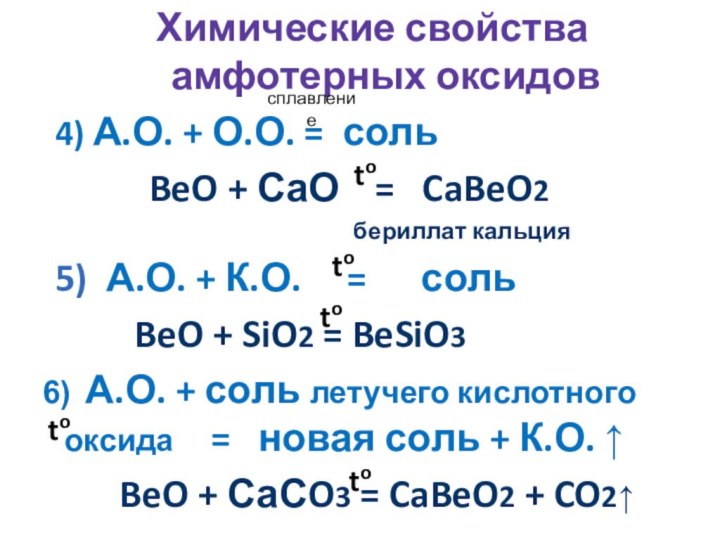
сплавление
to
to
to
to
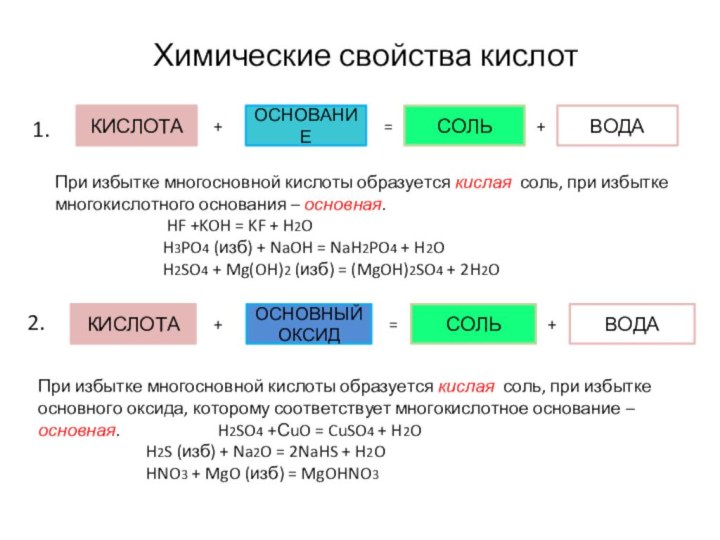
При избытке многосновной кислоты образуется кислая соль, при избытке основного оксида, которому соответствует многокислотное основание – основная. H2SO4 +СuO = CuSO4 + H2O
H2S (изб) + Na2O = 2NaHS + H2O
HNO3 + MgO (изб) = MgOHNO3
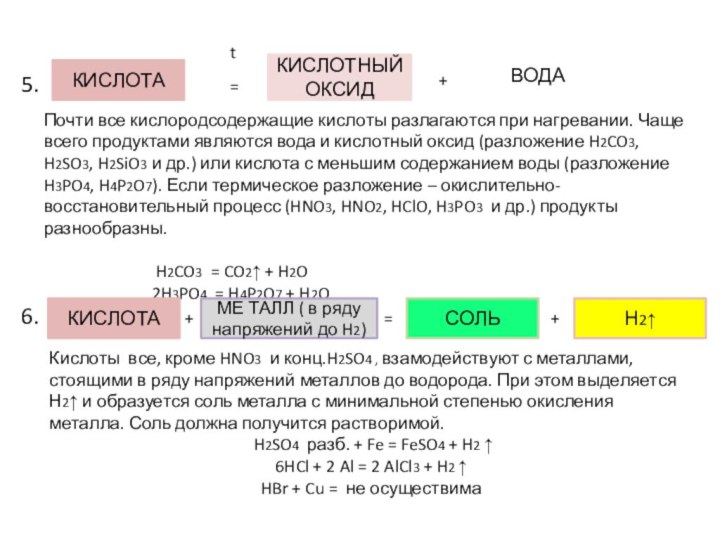
Химические свойства кислот
1.
2.
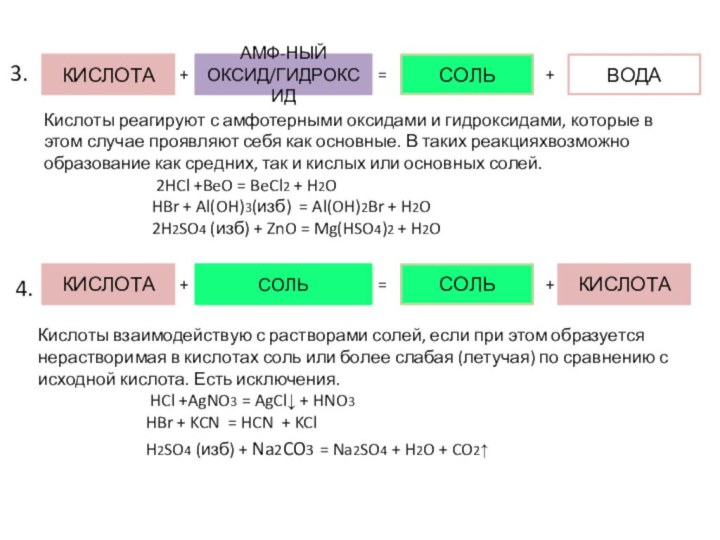
Кислоты взаимодействую с растворами солей, если при этом образуется нерастворимая в кислотах соль или более слабая (летучая) по сравнению с исходной кислота. Есть исключения.
HCl +AgNO3 = AgCl↓ + HNO3
HBr + KCN = HCN + KCl
H2SO4 (изб) + Na2CO3 = Na2SO4 + H2O + CO2↑
3.
4.