Слайд 2
ПОТЕНЦИАЛ И ТОК КОРРОЗИИ
I = (ок оа
) / R
I - ток гальванического элемента
ок
, оа - электрохимические потенциалы соответственно катода и анода, определенные при условии холостого хода гальванического элемента (при I = 0 )
R - сопротивление цепи анод-среда-катод
I = Ae / B
- смещение потенциала относительно своего равновесного состояния и обычно называемое перенапряжением процесса
A, B - некоторые константы, зависящие от параметров окружающей
среды и свойств металла
Rпол = / I
Rпол - сопротивление двойного электрического слоя металл-электролит
Слайд 3
Э.Д.С. элемента тратится на преодоление омического сопротивления коррозионной
среды в цепи между анодом и катодом и двух
поляризационных сопротивлений
ок оа = к + а + Uс
I = (к + а + Uс ) / ( Pк / Sк + Pа / Sa + Rс )
к, а - величина напряжения на поляризационном сопротивлении катода и анода соответственно
Uс - падение напряжения в коррозионной среде
Pк , Pа - удельные поляризационные сопротивления катода и анода, Ом.м2
Sк, Sa - площади катода и анода, м2
Rc - сопротивление среды между электродами, Ом
Слайд 4
Коррозионная диаграмма Эванса
Е = ок оа -
э.д.с. коррозионной гальванопары
а, к, Uc - напряжения участков цепи
соответственно на поляризационном сопротивлении анода, катода и в среде между ними
Слайд 5
С помощью коррозионной диаграммы Эванса можно сделать ряд

практических выводов:
Чем больше ток поляризации ( I ),
тем сильнее поляризуются - изменяют свой потенциал - электроды. При этом анод поляризуется положительно ( а > 0 ), т.е. его потенциал становится более положительным, а катод - отрицательно, так как к < 0.
В конечном счете электроды пары приобретают некоторый средний потенциал кор, называемый потенциалом коррозии. Этот потенциал в точности определялся бы точкой пересечения анодной и катодной характеристик, если бы можно было пренебречь омической составляющей цепи - падением напряжения в среде ( Uс ).
Ток коррозии Iкор зависит от разности электродных потенциалов (oa, ок ), которые, к сожалению, далеко не всегда известны, а не от потенциала коррозии кор. Несмотря на свое имя, потенциал коррозии не определяет ток коррозии, а скорее наоборот: при токе коррозии Iкор устанавливается некий компромисный потенциал кор.
Ток коррозии тем выше, чем меньше поляризационное сопротивление. Очевидно, что ток коррозии тем выше, чем меньше сопротивление среды.
Слайд 6
ПОЛЯРИЗАЦИЯ В ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССАХ
Равновесные потенциалы электродов могут быть
определены в условиях отсутствия в цепи тока. При
прохождении электрического
тока потенциалы
электродов меняются. Это явление называют
поляризацией:
∆φ = φi - φр ,
∆φ - поляризация
φi - потенциал электрода при прохождении тока
φр - равновесный потенциал (i = 0)
Слайд 7
Любая электрохимическая реакция многостадийна.
подвод реагентов к электроду
собственно
электрохимическая реакция
отвод продуктов реакции от электрода
возникновение поляризации обусловлено замедленностью
отдельных стадий электрохимического процесса
Изменение потенциала электрода вследствие изменения концентрации реагентов в приэлектродном слое при прохождении тока называется концентрационной поляризацией.
Изменение потенциала, обусловленное замедленностью собственно электрохимических стадий реакций, называется электрохимической поляризацией (перенапряжением).
Слайд 8
ПОЛЯРИЗАЦИОННЫЕ КРИВЫЕ ЭЛЕКТРОДОВ
U = φiK - φiA
U = Eэ - ∆φ K - ∆φ A - I· R
Таким образом, напряжение гальванического элемента при прохождении электрического тока меньше его напряжения при I » 0 вследствие поляризации электродов и омических потерь.
Слайд 9
Коррозия с участием кислорода протекает с его поглощением,
и ее называют коррозией с кислородной деполяризацией.
в кислой среде
(рН < 7)
в нейтральных и основных средах (рН > 7)
Слайд 10
Коррозия с участием ионов водорода сопровождается выделением водорода,
и ее называют коррозией с водородной деполяризацией.
в кислой среде
(рН < 7)
в нейтральных и основных средах (рН > 7)
Слайд 11
СКОРОСТЬ КОРРОЗИИ В СООТВЕТСТВИИ С ЗАКОНОМ ФАРАДЕЯ
Закон Фарадея:
количество электричества, стекающего с электрода, пропорционально потере массы этого
электрода
G = qIТ
q= 3600,M / (nF)
G - масса растворившегося металла, г
q - электрохимический эквивалент металла, гA-1.ч-1
M - атомная масса, г/моль
F = 96500 - число Фарадея, Кл/г.Экв
n - валентность металла; I - величина электродного тока, А
T - время, ч
Слайд 12
плотность тока коррозии
j = I / S
= G / (SqT)
практические формулы для расчета скорости коррозии
0,95 v1
j =
0,85 v2 ,
j – плотность анодного тока коррозии, А/м2
v1 - скорость весовой коррозии, г/(м2ч)
v2 - скорость проникающей коррозии, мм/год
величина плотности анодного тока есть мера скорости коррозии
Слайд 13
ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ СКОРОСТИ КОРРОЗИИ
Коррозиметры общего применения контролируют величину
поляризационного сопротивления двух электродов датчика, погружаемых в коррозионную среду
и подключаемых к внешнему источнику постоянного тока малого напряжения (U 10 мВ). При этом измеряют наложенный ток пары ( I ), определяют поляризационное сопротивление
Rпол = U / I и, вводя некоторый поправочный коэффициент, находят скорость коррозии.
Недостатки:
при измерениях фиксируют воздействие коррозионной среды на электроды датчика, но не на самое металлическое сооружение, ради которого проводятся измерения.
Метод не позволяет регистрировать какие-либо коррозионные гальванопары
По величине поляризационного сопротивления
Слайд 14
Гравиметрия
Измеряют общую коррозию образца-свидетеля,
который помещают в коррозионную
среду, по
возможности моделируя реальные условия
эксплуатации сооружения.
Недостатки:
Метод
широко применяется для лабораторных исследований, но мало пригоден для полевых.
Длительность.
Слайд 15
Контроль электросопротивления
Измерительными датчиками в данном случае являются
проволочные
или иные элементы,сопротивление которых
увеличивается в процессе их коррозионного
разрушения (за
счет уменьшения поперечного сечения). Коррозиметры,
построенные на этом принципе, - весьма точные электрические
измерительные приборы, позволяющие наблюдать коррозию
во времени.
Недостатки:
как и прочие методы измерения, регистрируют лишь коррозию датчиков, а не реального металлического сооружения.
Слайд 16
ПРОЧИЕ МЕТОДЫ
Ультразвуковой контроль позволяет определять фактическую толщину
стенки трубопровода или резервуара по изменению времени прохождения ультразвукового
сигнала через стенку.
Радиографический контроль осуществляют с помощью рентгеновских лучей, “просвечивая” стенку резервуара или аппарата.
Слайд 17
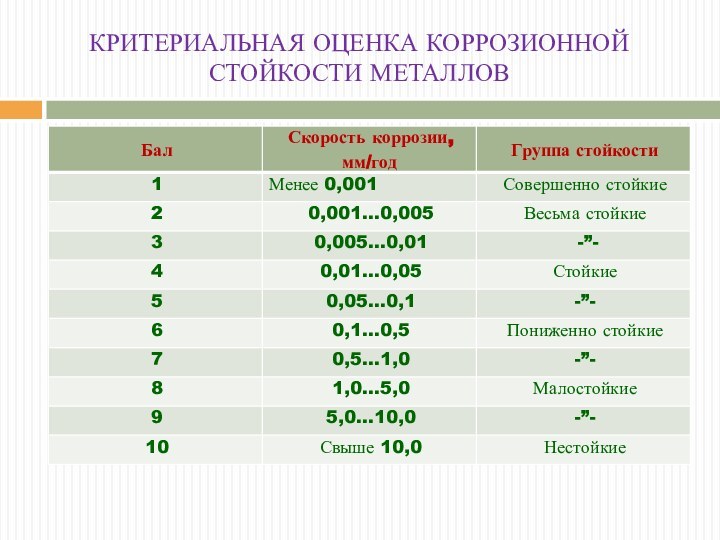
КРИТЕРИАЛЬНАЯ ОЦЕНКА КОРРОЗИОННОЙ СТОЙКОСТИ МЕТАЛЛОВ
Слайд 18
ОСНОВНЫЕ СЛУЧАИ ВОЗНИКНОВЕНИЯ КОРРОЗИОННЫХ ГАЛЬВАНИЧЕСКИХ ПАР
Коррозия при контакте
двух металлов
(-) Fe | водный раствор электролита |
Cu (+)
(-) A (Fe) : Е°Fe/Fe2+ = -0,44 В
ЕH2/2H+(рН = 10) = -0,59 В
(+) K (Cu): ЕOH-/O2 (рН = 10) = +0,64 В
возможна коррозия железа только с кислородной деполяризацией, так как ЕH2/2H+ < Е°Fe/Fe2+
2Fe + O2 + 2H2O = 2Fe(OH)2
Образующийся гидроксид железа (II) подвергается последующему окислению:
4Fe(OH)2 + O2 + H2O = 4Fe(OH)3
При этом образуется ржавчина (xFe2O3· yH2O).
Слайд 19
Коррозия металла с токопроводящими неметаллическими примесями
сталь наряду
с кристаллами собственно железа содержит
кристаллы цементита Fe3C, которые
по отношению к
железу выступают в роли катода в микрогальваническом
элементе
В ходе работы этого гальванического элемента на
электродах протекают следующие электрохимические
реакции:
(-) A (металл) :
(+) K (неметаллические включения) :
Слайд 20
Разрушение металлов при неодинаковой аэрации
Коррозия металлов возможна
при неодинаковом
доступе воздуха (аэрации) к его различным частям.
По этой причине наблюдается ржавление проволочных тросов изнутри, а не снаружи.