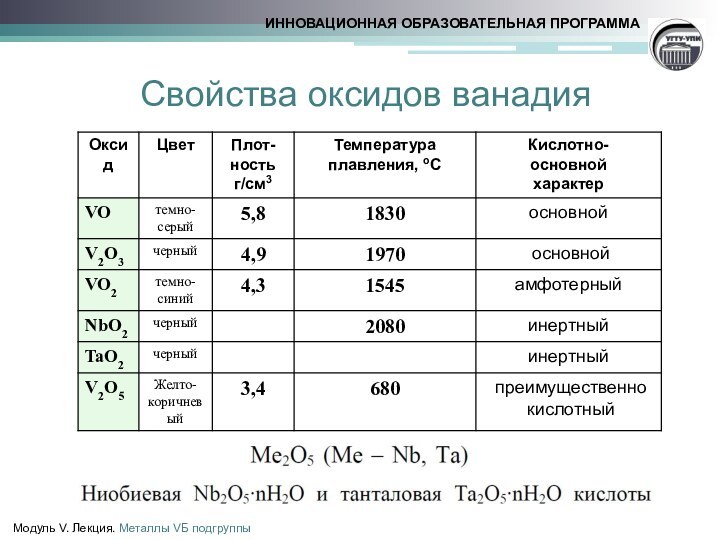
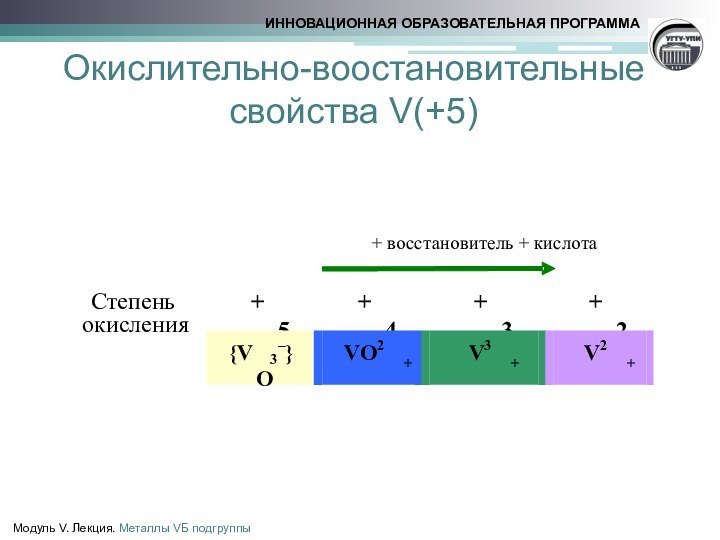
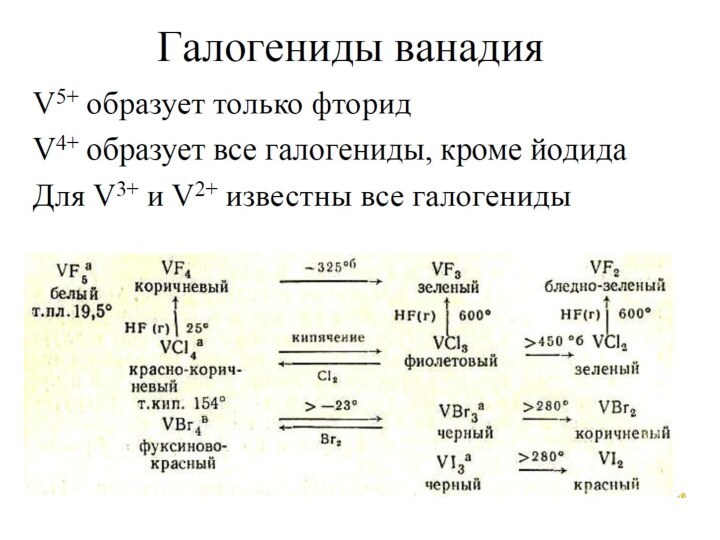
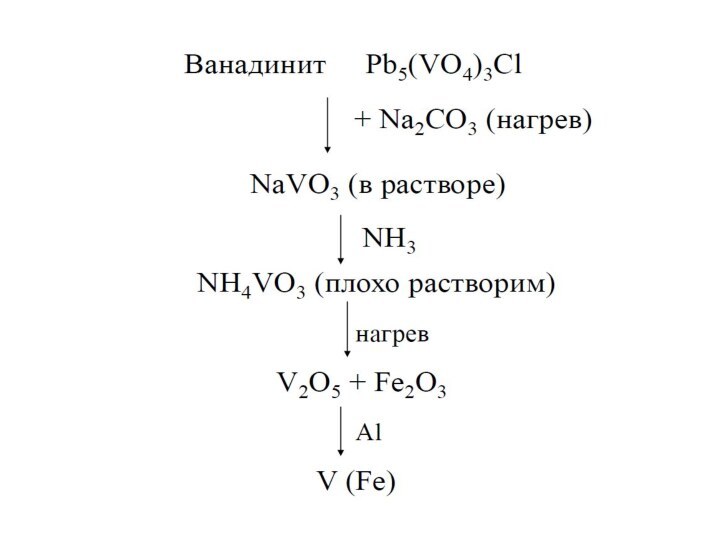
ванадит 3Pb3(VО4)2 •PbCl2
Содержание V в земной коре
составляет
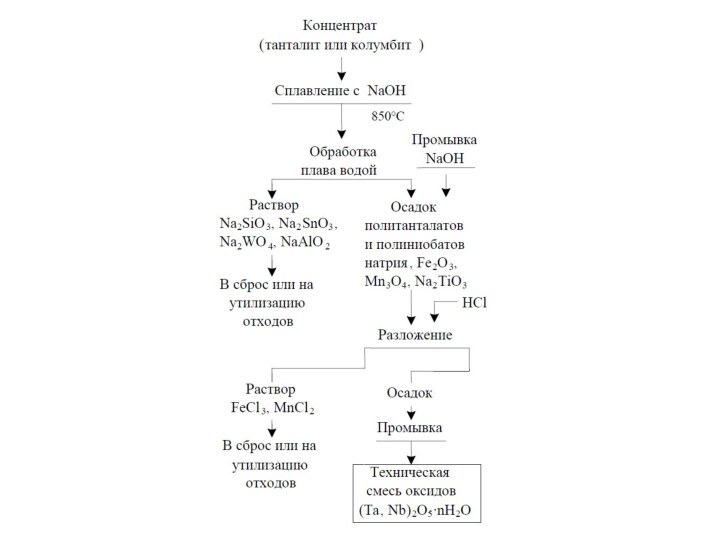
около 0,015 %Элементы Nb, Ta – достаточно распространенные элементы их содержание в земной коре оценивается в 103- 10-4%. Важнейшими минералами являются
Fe(TaO3)2 – танталит
Fe(NbO3)2– колумбит,
V(S2)2 – патронит

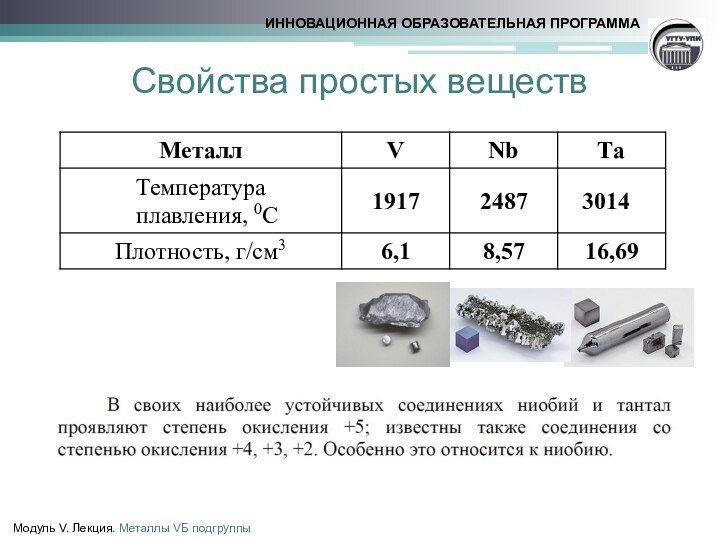
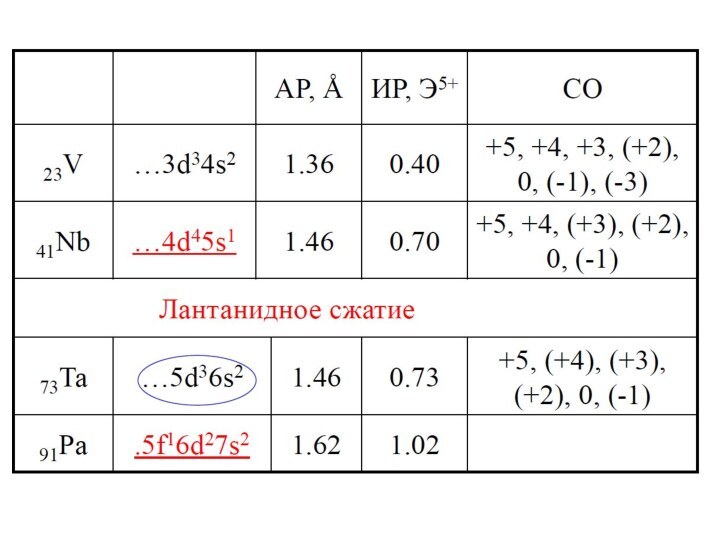





![Металлы VБ–подгруппы Свойства простых веществМодуль V. Лекция. Металлы VБ подгруппы2V + 12HF = 2H3[VF6]](/img/tmb/15/1432011/a46650c78d97cd694ec2f80df0810a17-720x.jpg)