- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Кальций(Ca)
Содержание
- 2. 1.Кальций2.История происхождения названия3.Физические свойства Кальция4.Химические свойства Кальция5.Получения Кальция6.Применение Кальция7.Кальций в организме8.Жесткая вода9.Устранение жесткостиПлан
- 3. Кальций (Calcium), Ca, химический элемент II группы
- 4. Название элемента происходит от лат. calx (в родительном
- 5. Кристаллическая решетка α-формы Ca (устойчивой при обычной
- 6. Конфигурация внешней электронной оболочки атома Ca 4s2,
- 7. Эти галогениды в расплавленном состоянии образуют с
- 8. В промышленности Ca получают двумя способами: 1)нагреванием
- 9. В виде чистого металла Ca применяют как
- 10. Ca - один из биогенных элементов, необходимых
- 11. Содержание Ca в крови человека и высших
- 12. Комплекс свойств, определяемых одним словом
- 13. Скачать презентацию
- 14. Похожие презентации
1.Кальций2.История происхождения названия3.Физические свойства Кальция4.Химические свойства Кальция5.Получения Кальция6.Применение Кальция7.Кальций в организме8.Жесткая вода9.Устранение жесткостиПлан












Слайд 2
1.Кальций
2.История происхождения названия
3.Физические свойства Кальция
4.Химические свойства Кальция
5.Получения Кальция
6.Применение
Кальция
Слайд 3 Кальций (Calcium), Ca, химический элемент II группы периодической
системы Менделеева, атомный номер 20, атомная масса 40,08; серебряно-белый
легкий металл. Природный элемент представляет смесь шести стабильных изотопов: 40Ca, 42Ca, 43Ca, 44Ca, 46Ca и 48Ca, из которых наиболее распространен 40Ca (96, 97%).Кальций(Ca)
Слайд 4 Название элемента происходит от лат. calx (в родительном падеже calcis) —
«известь», «мягкий камень». Оно было предложено английским химиком Хэмфри Дэви,
в 1808 г. выделившим металлический кальций электролитическим методом. Дэви подверг электролизу смесь влажной гашёной извести с оксидом ртути HgO на платиновой пластине, которая являлась анодом. Катодом служила платиновая проволока, погруженная в жидкую ртуть. В результате электролиза получалась амальгама кальция. Отогнав из неё ртуть, Дэви получил металл, названный кальцием.История и происхождение названия
Слайд 5 Кристаллическая решетка α-формы Ca (устойчивой при обычной температуре)
гранецентрированная кубическая, а = 5,56Å. Атомный радиус 1,97Å, ионный
радиус Ca2+, 1,04Å. Плотность 1,54 г/см3(20 °C). Выше 464 °C устойчива гексагональная β-форма. tпл 851 °C, tкип 1482 °C; температурный коэффициент линейного расширения 22·10-6 (0-300 °C); теплопроводность при 20 °C 125,6 Вт/(м·К) или 0,3 кал/(см·сек·°C); удельная теплоемкость (0-100 °C) 623,9 дж/(кг·К) или 0,149 кал/(г·°C); удельное электросопротивление при 20 °C 4,6·10-8 ом·м или 4,6·10-6ом·см; температурный коэффициент электросопротивления 4,57·10-3 (20 °C). Модуль упругости 26 Гн/м2 (2600 кгс/мм2); предел прочности при растяжении 60 Мн/м2 (6 кгс/мм2); предел упругости 4 Мн/м2 (0,4 кгс/мм2), предел текучести 38 Мн/м2 (3,8 кгс/мм2); относительное удлинение 50%; твердость по Бринеллю 200-300 Мн/м2 (20-30 кгс/мм2). Кальций достаточно высокой чистоты пластичен, хорошо прессуется, прокатывается и поддается обработке резанием.Физические свойства Кальция
Слайд 6 Конфигурация внешней электронной оболочки атома Ca 4s2, в
соответствии с чем Ca в соединениях 2-валентен. Химически Ca
очень активен. При обычной температуре Ca легко взаимодействует с кислородом и влагой воздуха, поэтому его хранят в герметически закрытых сосудах или под минеральным маслом. При нагревании на воздухе или в кислороде воспламеняется, давая основной оксид CaO. Известны также пероксиды Ca - CaO2 и CaO4. С холодной водой Ca взаимодействует сначала быстро, затем реакция замедляется вследствие образования пленки Ca(OH)2. Ca энергично взаимодействует с горячей водой и кислотами, выделяя H2 (кроме концентрированной HNO3). С фтором реагирует на холоду, а с хлором и бромом - выше 400 °C, давая соответственно CaF2, CaCl2 и CaBr2.Химические свойства Кальция
Слайд 7 Эти галогениды в расплавленном состоянии образуют с Ca
так называемых субсоединения - CaF, CaCl, в которых Ca
формально одновалентен. При нагревании Ca с серой получается сульфид кальция CaS, последний присоединяет серу, образуя полисульфиды (CaS2, CaS4 и другие). Взаимодействуя с сухим водородом при 300-400 °C, Ca образует гидрид CaH2 - ионное соединение, в котором водород является анионом. При 500 °C Ca и азот дают нитрид Ca3N2; взаимодействие Ca с аммиаком на холоду приводит к комплексному аммиакату Ca [NH3]6. При нагревании без доступа воздуха с графитом, кремнием или фосфором Ca дает соответственно карбид кальция CaC2, силициды Ca2Si, CaSi, CaSi2 и фосфид Ca3P2. Ca образует интерметаллические соединения с Al, Ag, Au, Cu, Li, Mg, Pb, Sn и другие.
Слайд 8
В промышленности Ca получают двумя способами:
1)нагреванием брикетированной
смеси CaO и порошка Al при 1200 °C в
вакууме 0,01-0,02 мм рт. ст.; выделяющиеся по реакции:6CaO + 2 Al = 3CaO·Al2O3 + 3Ca пары Ca конденсируются на холодной поверхности;
2) электролизом расплава CaCl2 и KCl с жидким медно-кальциевым катодом приготовляют сплав Cu - Ca (65% Ca), из которого Ca отгоняют при температуре 950-1000 °C в вакууме 0,1-0,001 мм рт. ст.
Получение Кальция
Слайд 9 В виде чистого металла Ca применяют как восстановитель
U, Th, Cr, V, Zr, Cs, Rb и некоторых
редкоземельных металлов из их соединений. Его используют также для раскисления сталей, бронз и других сплавов, для удаления серы из нефтепродуктов, для обезвоживания органических жидкостей, для очистки аргона от примеси азота и в качестве поглотителя газов в электровакуумных приборах. Большое применение в технике получили антифрикционные материалы системы Pb-Na-Ca, а также сплавы Pb-Ca, служащие для изготовления оболочки электрич. кабелей. Сплав Ca-Si-Ca (силикокальций) применяется как раскислитель и дегазатор в производстве качественных сталей.Применение Кальция
Слайд 10 Ca - один из биогенных элементов, необходимых для
нормального протекания жизненных процессов. Он присутствует во всех тканях
и жидкостях животных и растений. Лишь редкиеорганизмы могут развиваться
в среде, лишенной Ca. У
некоторых организмов
содержание Ca достигает
38%; у человека - 1,4-2%.
Кальций в организме
Слайд 11 Содержание Ca в крови человека и высших животных
регулируется гормонами паращитовидных и щитовидной желез. Важнейшую роль в
этих процессах играет витамин D. Всасывание Ca происходит в переднем отделе тонкого кишечника. Усвоение Ca ухудшается при снижении кислотности в кишечнике и зависит от соотношения Ca, P и жира в пище. Оптимальные соотношения Са / Р в коровьем молоке около 1,3 (в картофеле 0,15, в бобах 0,13, в мясе 0,016). При избытке в пище P или щавелевой кислоты всасывание Ca ухудшается. Желчные кислоты ускоряют его всасывание. Оптимальные соотношения Са / жир в пище человека 0,04-0,08 г Ca на 1 г жира. Выделение Ca происходит главным образом через кишечник. Млекопитающие в период лактации теряют много Ca с молоком. При нарушениях фосфорно-кальциевого обмена у молодых животных и детей развивается рахит, у взрослых животных - изменение состава и строения скелета (остеомаляция).Слайд 12 Комплекс свойств, определяемых одним словом «жесткость»,
воде придают растворенные в ней соли кальция и магния.
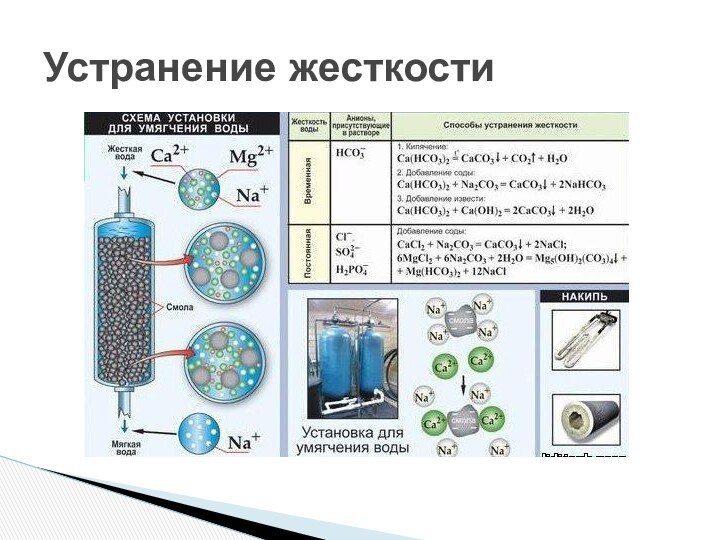
Жесткая вода непригодна во многих случаях жизни. Она образует слой накипи в паровых котлах и котельных установках, затрудняет окраску и стирку тканей, но годится для варки мыла и приготовления эмульсий в парфюмерном производстве. Поэтому раньше, когда способы умягчения воды были несовершенны, текстильные и парфюмерные предприятия обычно размещались поблизости от источников «мягкой» воды.Различают жесткость временную и постоянную. Временную (или карбонатную) жесткость придают воде растворимые гидрокарбонаты Са(НCO3)2 и Mg(HCO3)2
Жесткая вода





























