- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему ИНТЕРМЕДИАТЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ
Содержание
- 2. ИНТЕРМЕДИАТЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ
- 3. В органической химии известно несколько типов частиц, в которых валентность атома углерода отлична от четырех
- 4. Обычно это короткоживущие частицы, существующие только
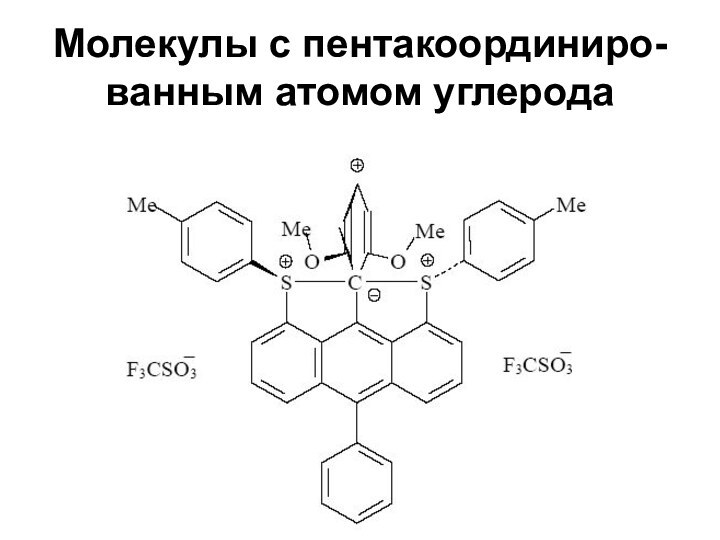
- 5. Молекулы с пентакоординиро- ванным атомом углерода
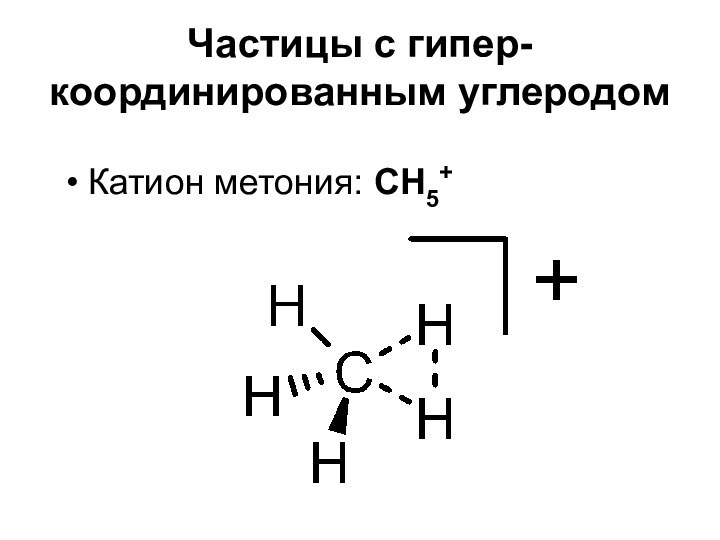
- 6. Частицы с гипер-координированным углеродомКатион метония: CH5+
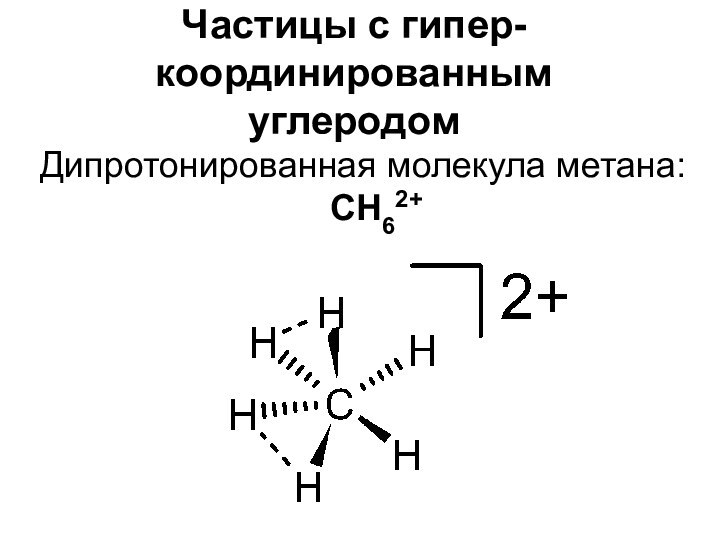
- 7. Частицы с гипер-координированным углеродомДипротонированная молекула метана: CH62+
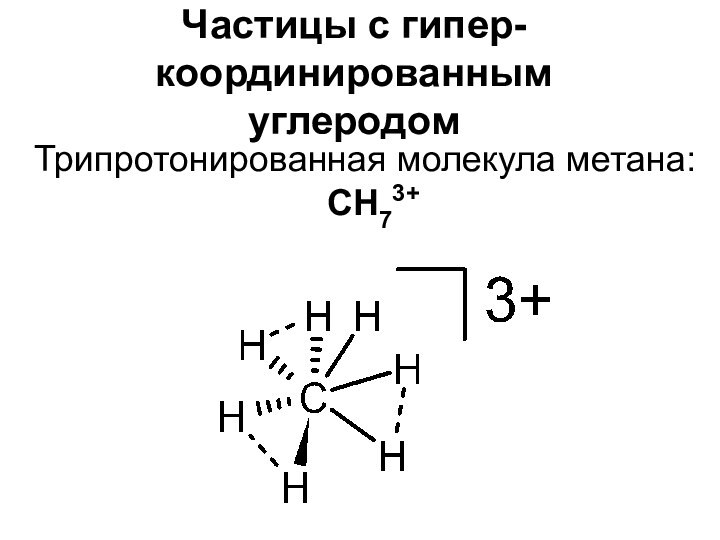
- 8. Частицы с гипер-координированным углеродомТрипротонированная молекула метана: CH73+
- 9. Классификация интермедиатовРадикалыКарбокатионыКарбанионыКарбеныНитреныАрины
- 10. КарбкатионыКарбкатионы – положительно заряженные частицы, у которых положительный заряд сосредоточен на атоме углеродаR3C+
- 11. Устойчивость карбкатионовОни наиболее устойчивы в растворах (в
- 12. Устойчивость карбкатионовУменьшается в ряду: R3C+ > R2HC+
- 13. Устойчивость карбкатионов
- 14. Устойчивость карбкатионовСопряжение с двойной связью повышает устойчивость системы вследствие увеличения делокализации заряда
- 15. Аллильный катион
- 16. Бензильный карбкатион
- 17. Устойчивость карбкатионовТрифенилметил- и дифенилметил-катионы были выделены в виде твердых солейPh3C+BF4- - продажный реактив
- 18. Устойчивость карбкатионовНаличие в соседнем положении гетероатома повышает устойчивость карбкатионовМеОСН2+ВF6- - устойчивое твердое вещество
- 19. Пространственная структура карбкатионовsp2-гибридизация атома углеродаСтруктура плоская
- 20. Способы генерации карбкатионов Прямая ионизация, при которой
- 21. Способы генерации карбкатионовАлканы образуют карбкатионы в суперкислотах
- 22. Способы генерации карбкатионовРастворы фторсульфоновой кислоты (FSO3H) и
- 23. Способы генерации карбкатионовПрисоединение протона или другой положительно
- 24. Реакции карбкатионовКомбинация с частицей, имеющей электронную пару:
- 25. Реакции карбкатионовПотеря атомом, соседним с карбкатионным центром,
- 26. Реакции карбкатионовПерегруппировка CH3CH2CH2+ CH3CH+CH3Присоединение по двойной
- 27. КарбанионыКарбанионы – отрицательно заряженные частицы, у которых заряд сосредоточен на атоме углеродаR3C-
- 28. Устойчивость карбанионовАлкильные карбанионы очень не устойчивы в
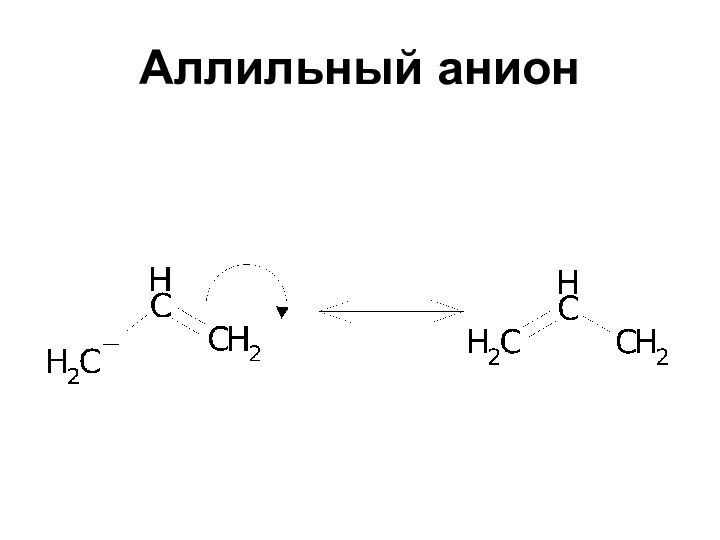
- 29. Аллильный анион
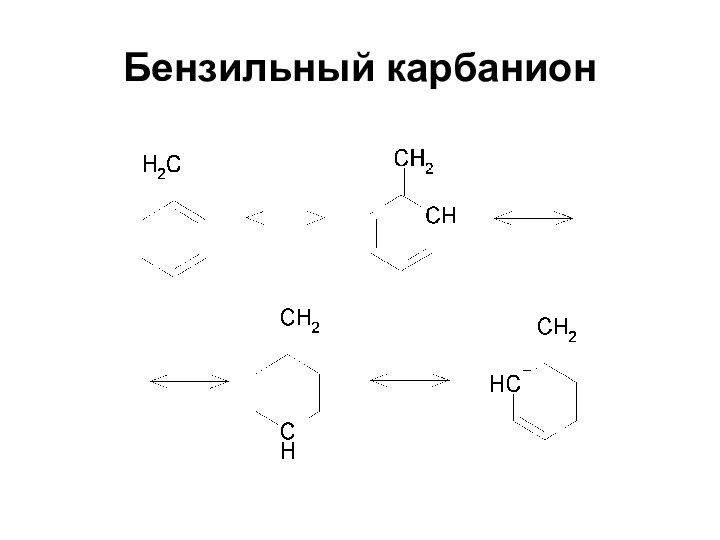
- 30. Бензильный карбанион
- 31. Устойчивость карбанионовЕще более устойчивы дифенилметил- и
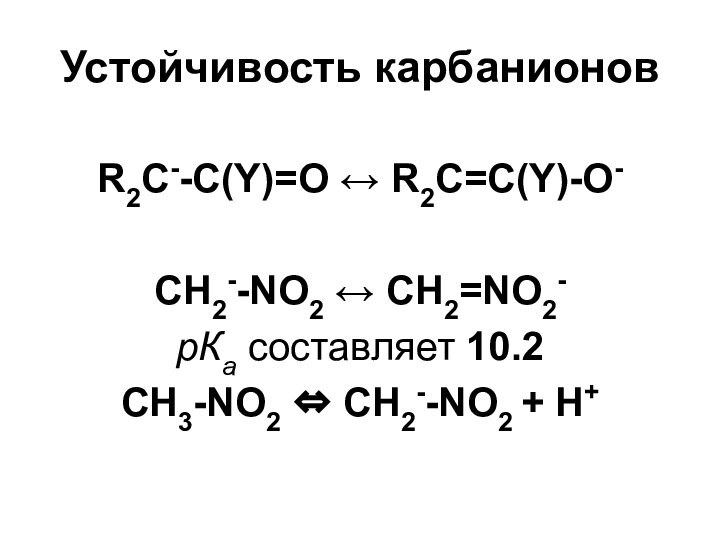
- 32. Устойчивость карбанионовR2C--C(Y)=O R2C=C(Y)-O-CH2--NO2 CH2=NO2-рКа составляет 10.2 CH3-NO2 CH2--NO2 + Н+
- 33. Устойчивость карбанионовCтабилизирующий эффект функциональных групп в -положении
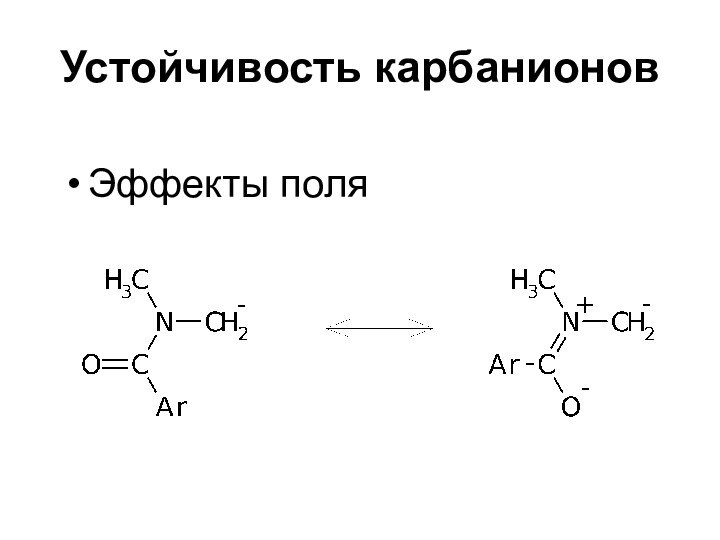
- 34. Устойчивость карбанионовЭффекты поля
- 35. Устойчивость карбанионовАроматический характер
- 36. Пространственная структура карбанионовsp3-гибридизация атома углерода неподеленная
- 37. Способы получения карбанионов Отщепление протонаR-H R- + H+
- 38. Способы получения карбанионов Присоединение к С=С связиCH2=CH2
- 39. Реакции карбанионовКомбинация с положительно заряженной частицей:
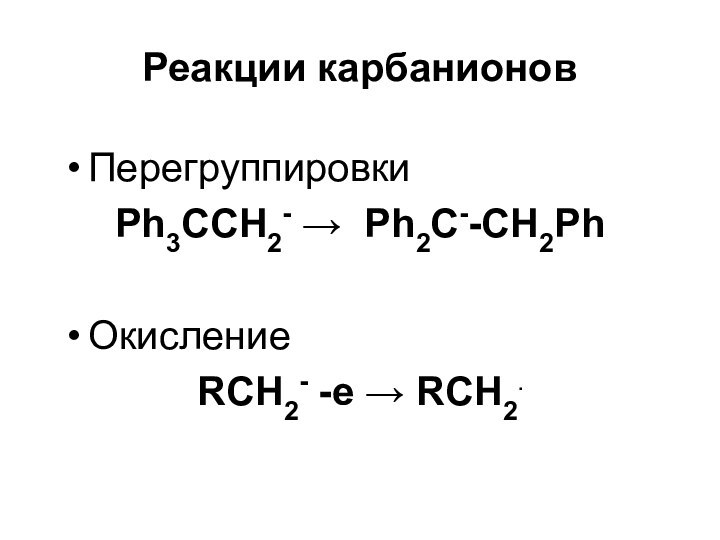
- 40. Реакции карбанионовПерегруппировкиPh3CCH2- Ph2C--CH2PhОкислениеRСH2- -e RCH2
- 41. Свободные радикалы Радикалы - частицы, содержащие неспаренный
- 42. Устойчивость свободных радикаловУстойчивость уменьшается в ряду: третичный > вторичный > первичный
- 43. Пространственная структура радикаловПирамидальная структура Плоская
- 44. Способы получения радикалов Термическое или фотохимическое расщепление
- 45. Реакции радикаловОкисление или восстановлениеСоединение радикаловR + R R-R
- 46. Реакции радикаловДиспропорционирование: 2
- 47. Реакции радикаловПрисоединение к кратной связи СН3СН2 + CH2=CH2 CH3CH2CH2CH2Перегруппировки первичные вторичные третичные
- 48. Ион-радикалыИон-радикалы - частицы, имеющие неспаренный электрон и
- 49. Ион-радикалы
- 50. Карбены Карбены - высокореакционноспособные частицы, имеющие два
- 51. Способы получения карбенов -Элиминированием от углерода СНCl3
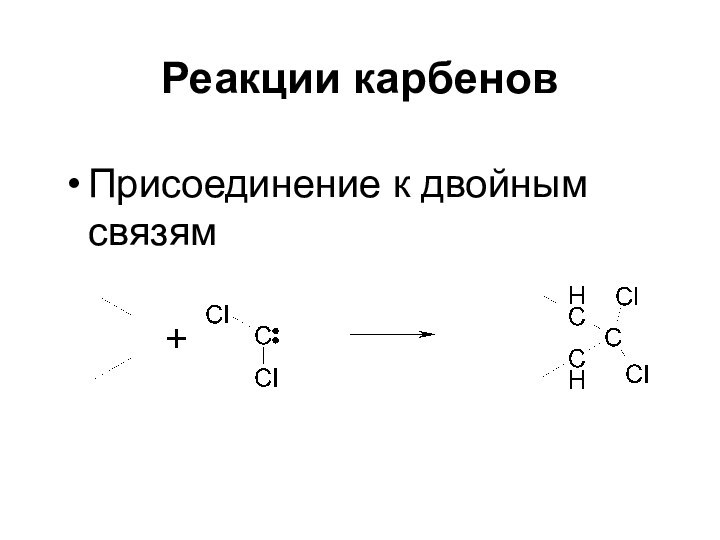
- 52. Реакции карбенов Присоединение к двойным связям
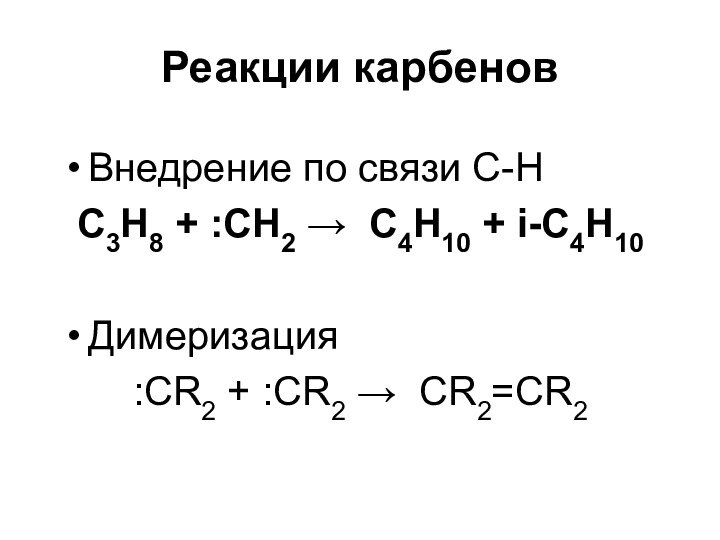
- 53. Реакции карбеновВнедрение по связи С-Н С3Н8 +
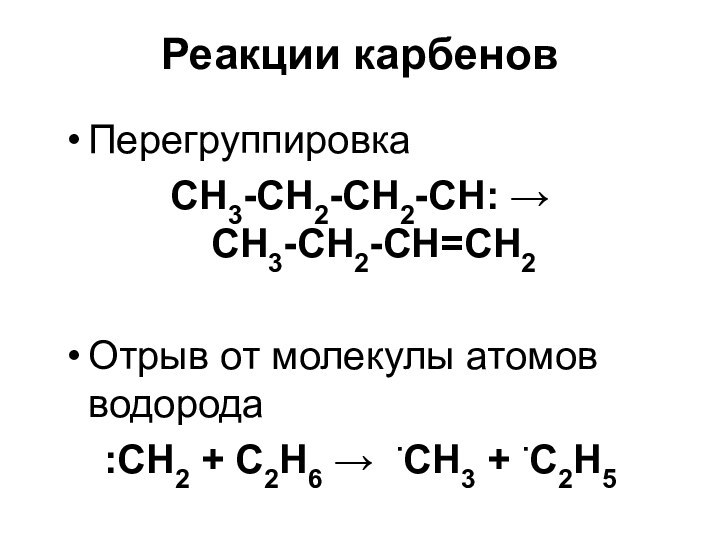
- 54. Реакции карбеновПерегруппировка СН3-СН2-СН2-СН: СН3-СН2-СН=СН2 Отрыв
- 55. НитреныАналоги карбеновЧастицы одновалентного азота RNПолучают термическим или фотохимическим разложением азидов
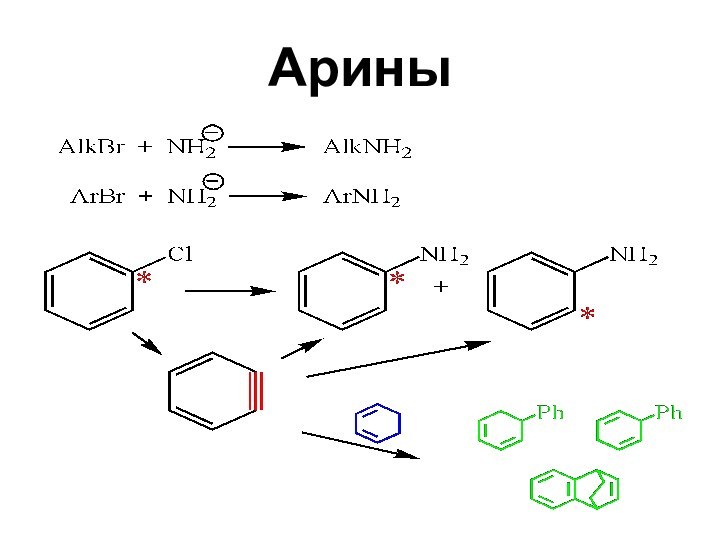
- 56. Арины
- 57. Скачать презентацию
- 58. Похожие презентации
ИНТЕРМЕДИАТЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ
































Слайд 3 В органической химии известно несколько типов частиц, в
которых валентность атома углерода отлична от четырех
Слайд 4 Обычно это короткоживущие частицы, существующие только в
виде интермедиатов, которые претерпевают быстрое превращение в более устойчивые
молекулы (некоторые из них отличаются большей устойчивостью, и их удается выделить)
Слайд 10
Карбкатионы
Карбкатионы – положительно заряженные частицы,
у которых положительный
заряд сосредоточен
на атоме углерода
R3C+
Слайд 11
Устойчивость карбкатионов
Они наиболее устойчивы в растворах (в некоторых
случаях их удается выделить в виде солей)
В полярных растворителях
могут быть свободными (сольватированы) В неполярных растворителях существуют в виде ионных пар, т.е. тесно связанны с отрицательным ионом
Слайд 12
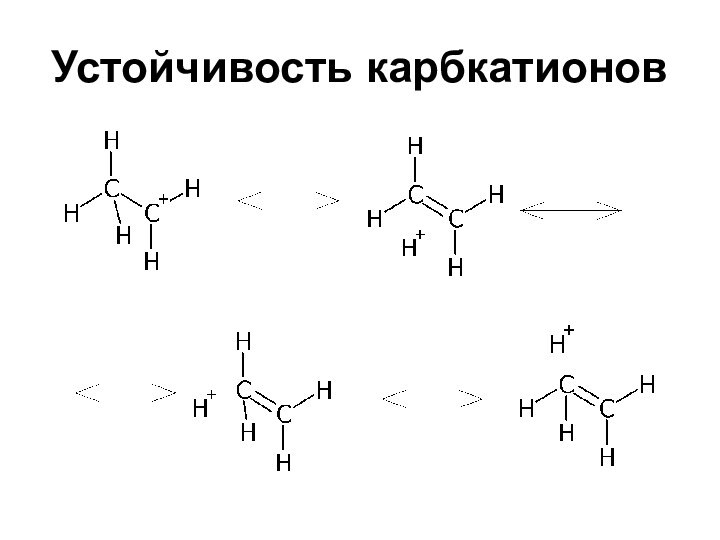
Устойчивость карбкатионов
Уменьшается в ряду:
R3C+ > R2HC+ >
RH2C+ > H3C+
Известны перегруппировки первичных и вторичных
карбкатионов в третичныеОбъясняется гиперконъюгацией или эффектом поля
Слайд 14
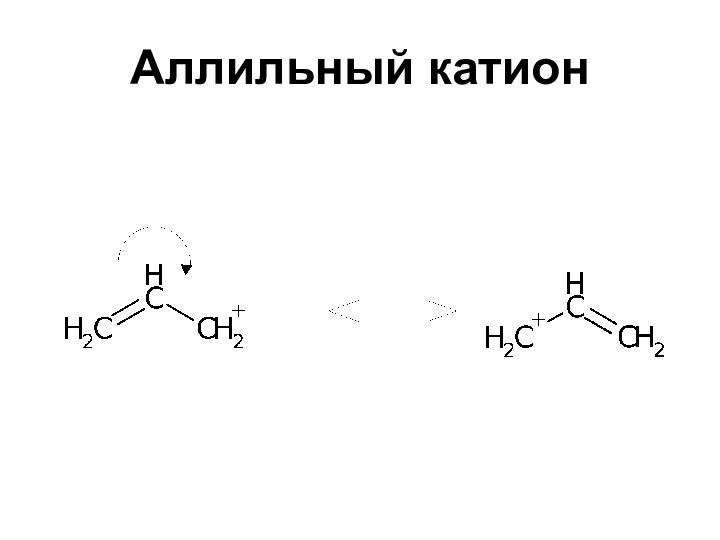
Устойчивость карбкатионов
Сопряжение с двойной связью повышает устойчивость
системы вследствие увеличения делокализации заряда
Слайд 17
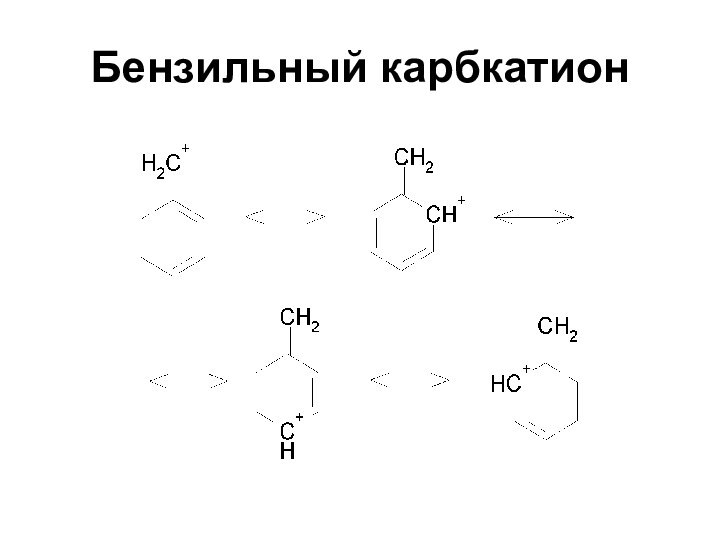
Устойчивость карбкатионов
Трифенилметил- и дифенилметил-катионы были выделены в виде
твердых солей
Ph3C+BF4- - продажный реактив
Слайд 18
Устойчивость карбкатионов
Наличие в соседнем положении гетероатома повышает устойчивость
карбкатионов
МеОСН2+ВF6- - устойчивое твердое вещество
Слайд 20
Способы генерации карбкатионов
Прямая ионизация, при которой группа,
связанная с атомом углерода, уходит вместе с электронной парой
(процесс обратимый)R3CX R3C+ + X-
Слайд 21
Способы генерации карбкатионов
Алканы образуют карбкатионы в суперкислотах за
счет потери гидрид-иона (легче всего от третичного, труднее от
первичного)
Слайд 22
Способы генерации карбкатионов
Растворы фторсульфоновой кислоты (FSO3H) и пентафторида
сурьмы (SbF5) в SO2 или SO2ClF являются самыми сильными
из известных кислых растворов и называются суперкислотами
Слайд 23
Способы генерации карбкатионов
Присоединение протона или другой положительно заряженной
частицы к одному из атомов ненасыщенной системы
R2C=Y +
H+ R2C+-YH
Слайд 24
Реакции карбкатионов
Комбинация с частицей, имеющей электронную пару:
R3С+ + Y- R3С-Y
R3С+
+ :Y R3С-Y+
Слайд 25
Реакции карбкатионов
Потеря атомом, соседним с карбкатионным центром, протона
или другого положительного иона:
R2C+-Z-H
R2C=Z + H+
Слайд 26
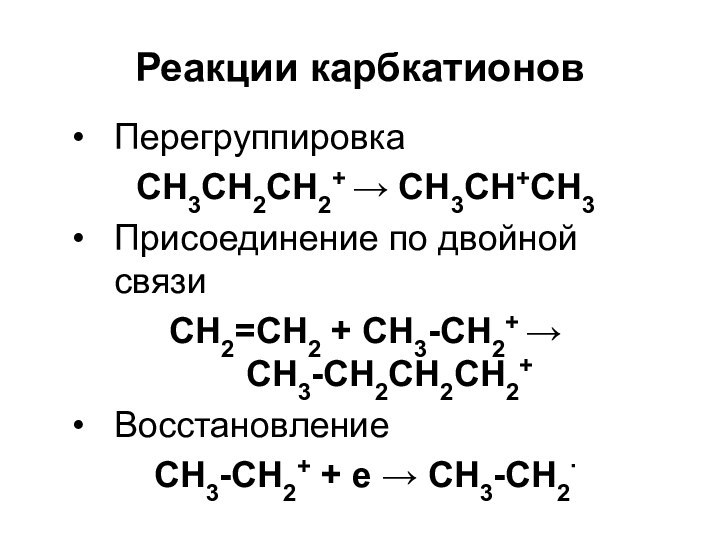
Реакции карбкатионов
Перегруппировка
CH3CH2CH2+ CH3CH+CH3
Присоединение по двойной связи
CH2=CH2 + CH3-CH2+
CH3-CH2CH2CH2+
Восстановление
CH3-CH2+ + e CH3-CH2
Слайд 27
Карбанионы
Карбанионы – отрицательно заряженные частицы,
у которых заряд
сосредоточен
на атоме углерода
R3C-
Слайд 28
Устойчивость карбанионов
Алкильные карбанионы очень не устойчивы в растворах
Устойчивость уменьшается в ряду: фенил > винил > циклопропил
> метил > > первичный > вторичный > третичный
Слайд 31
Устойчивость карбанионов
Еще более устойчивы
дифенилметил- и
трифенилметил-анионы, которые сохраняются в растворах неопределенно долгое время
при условии абсолютного отсутствия воды
Слайд 32
Устойчивость карбанионов
R2C--C(Y)=O R2C=C(Y)-O-
CH2--NO2 CH2=NO2-
рКа составляет 10.2
CH3-NO2 CH2--NO2 + Н+
Слайд 33
Устойчивость карбанионов
Cтабилизирующий эффект функциональных групп в -положении к
карбанионному центру убывает в ряду:
NO2 > RCO >
COOR > SO2 > CN ~ CONH2 > Hlg > H > R
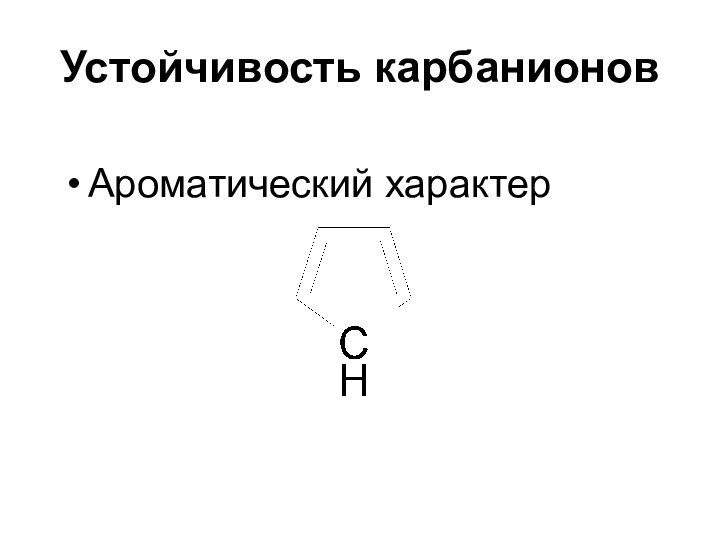
Слайд 36
Пространственная структура карбанионов
sp3-гибридизация атома углерода неподеленная электронная
пара занимает одну из вершин тетраэдра (пирамидальная структура)
sp2-гибридизация
атома углерода (стабилизация резонансом)
Структура плоская
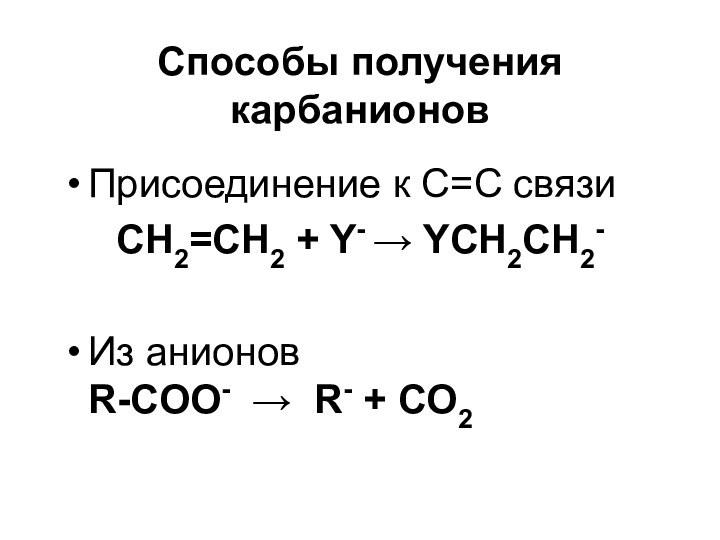
Слайд 38
Способы получения карбанионов
Присоединение к С=С связи
CH2=CH2 +
Y- YCH2CH2-
Из анионов
R-COO- R- + CO2
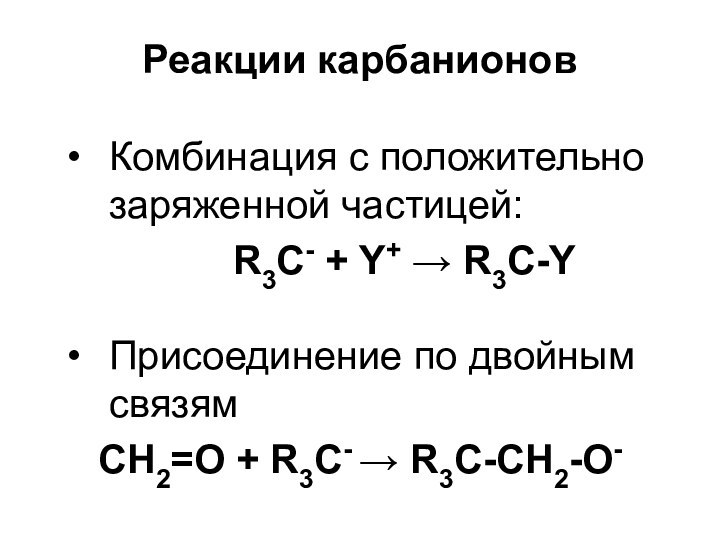
Слайд 39
Реакции карбанионов
Комбинация с положительно заряженной частицей:
R3С- + Y+ R3С-Y
Присоединение по
двойным связям CH2=О + R3C- R3C-CH2-O-
Слайд 41
Свободные радикалы
Радикалы - частицы, содержащие неспаренный электрон
(являются парамагнитными частицами)
Для их детектирования используют метод электронного парамагнитного
резонанса (ЭПР)
Слайд 42
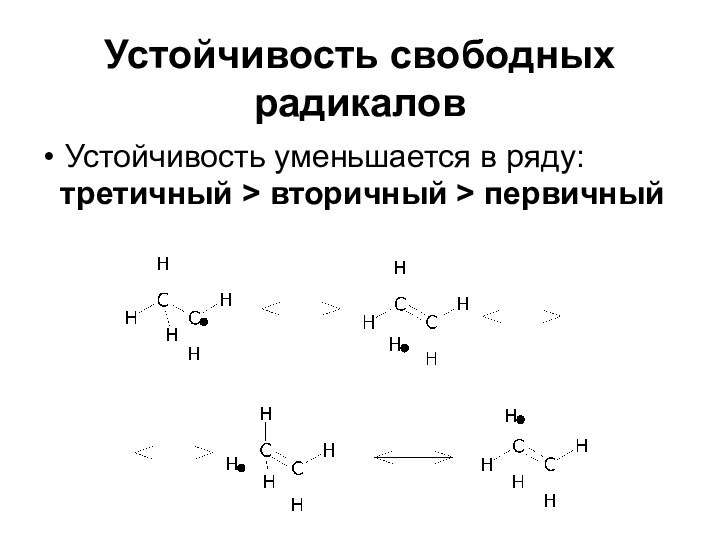
Устойчивость свободных радикалов
Устойчивость уменьшается в ряду:
третичный >
вторичный > первичный
Слайд 44
Способы получения радикалов
Термическое или фотохимическое расщепление
R-R
R + R
RH + R’ R
+ R’HR- -e R
Слайд 46
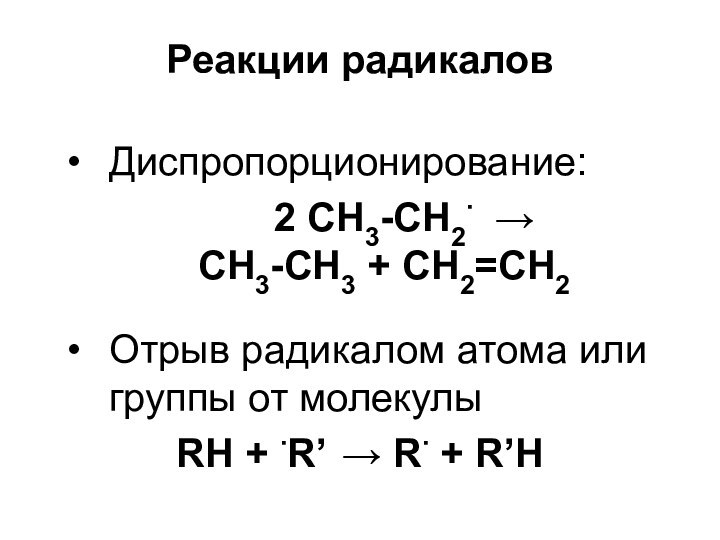
Реакции радикалов
Диспропорционирование:
2 СН3-СН2
CH3-CH3 + CH2=CH2
Отрыв радикалом атома или
группы от молекулы RH + R’ R + R’H
Слайд 47
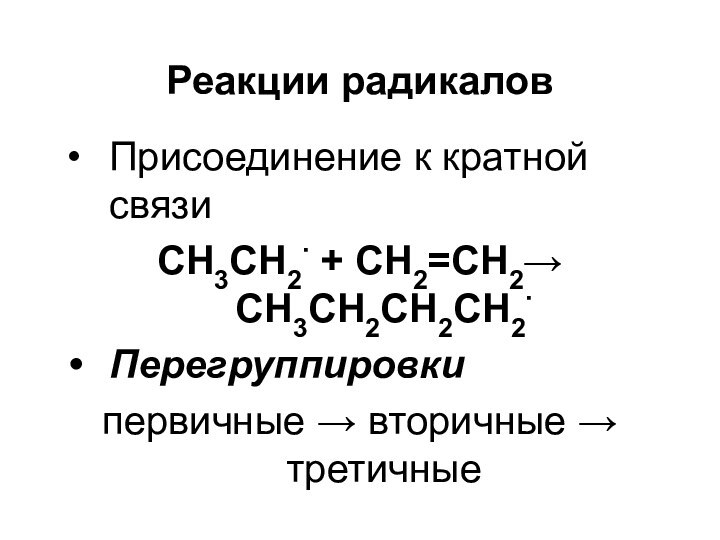
Реакции радикалов
Присоединение к кратной связи
СН3СН2 + CH2=CH2
CH3CH2CH2CH2
Перегруппировки
первичные вторичные третичные
Слайд 48
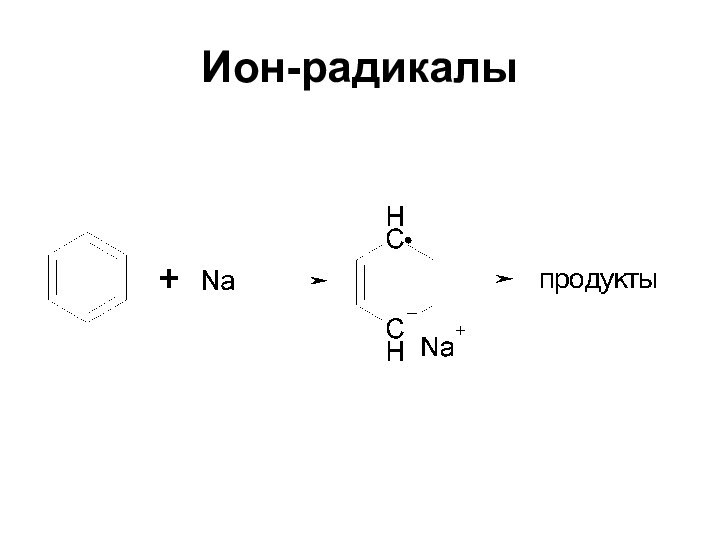
Ион-радикалы
Ион-радикалы - частицы, имеющие неспаренный электрон и заряд
Неспаренный
электрон и заряд могут находиться на атомах отличных от
углерода (семихиноны, кетилы)Лишь в немногих ион-радикалах неспаренный электрон и заряд находятся на атомах углерода
Слайд 50
Карбены
Карбены - высокореакционноспособные частицы, имеющие два неспаренных
электрона
Их удается получить только в матрицах при низких температурах
Карбен - это метилен СH2
Дихлоркарбен СCl2
Слайд 51
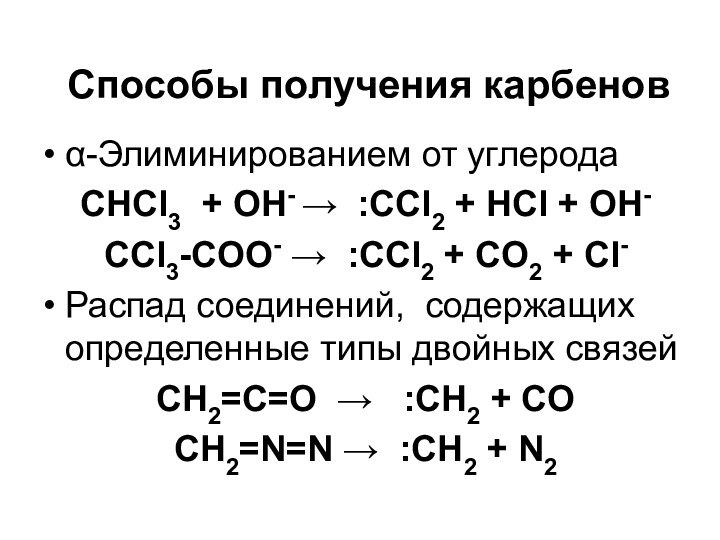
Способы получения карбенов
-Элиминированием от углерода
СНCl3 +
OH- :CCl2 + HCl + OH-
CCl3-COO-
:CCl2 + CO2 + Cl-Распад соединений, содержащих определенные типы двойных связей
CH2=C=O :CH2 + CO
CH2=N=N :CH2 + N2





























