aA + bB → pP + qQ,
Происходящей в
одну стадию в закрытой системе при постоянном объёме можно записать: Экспериментально скорость реакции определяется с помощью кинетических кривых
Vмгнов = tg угла наклона касательной в данный момент времени
Концентрация A (A0 = 0.25 моль/l) и B (продукта) относительно времени
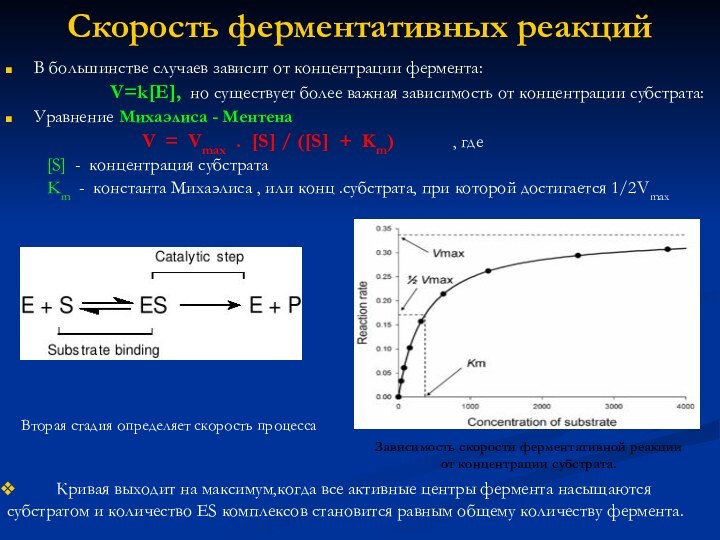
“Скорость реакции – это число элементарных взаимодействий за единицу времени в единице объёма.” Или это изменение концентрации какого либо реагента или продукта в единицу времени при постоянном объёме.
Средняя скорость :
v сред. = ± (C2 –C1 ) / ( t2 – t1 )= ∆C/∆t ( моль/л.с)
мгновенная : v мгнов.= ±dC/dt
‘ + ‘ для концентрации продуктов , ‘ – ‘ для реагентов