Cu2+ + 2Cl-
Анод(+)восстановление: окисление:
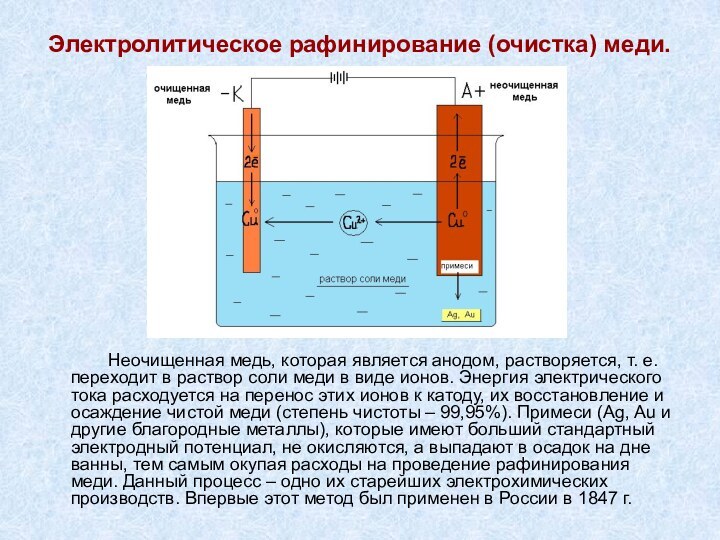
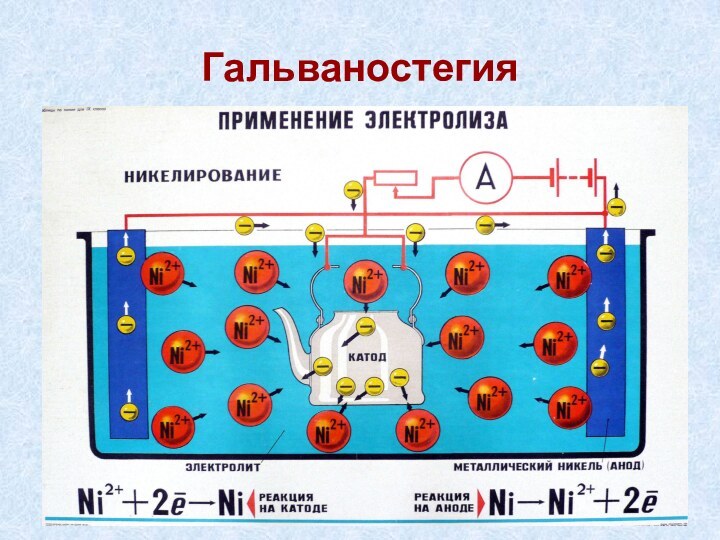
Cu2+ +2е- = Сu0 2Cl- - 2е- = Cl2↑
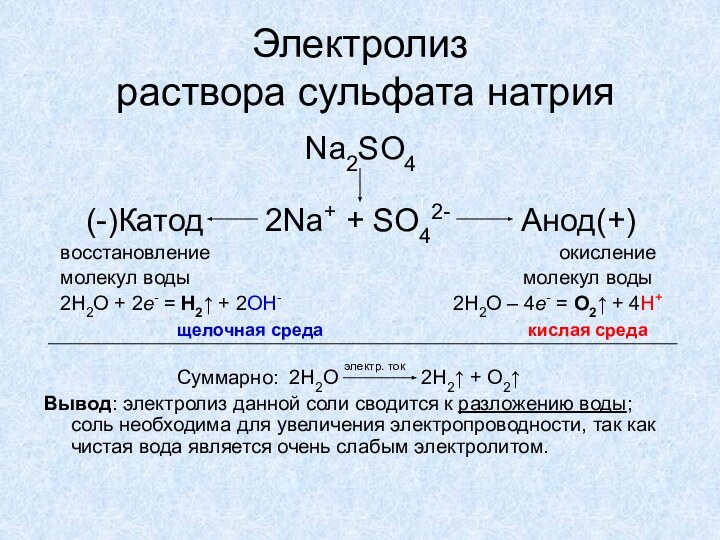
Суммарно: CuCl2 Сu + Cl2
Вывод: электролиз раствора данной соли принципиально не отличается от электролиза ее расплава.
электр. ток
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть











электр. ток
электр. ток
электр. ток
электр. ток