Неорганические
Углеводороды Кислородосодержащие Азотсодержащие
По
порядку
соединения
атомов в
молекуле
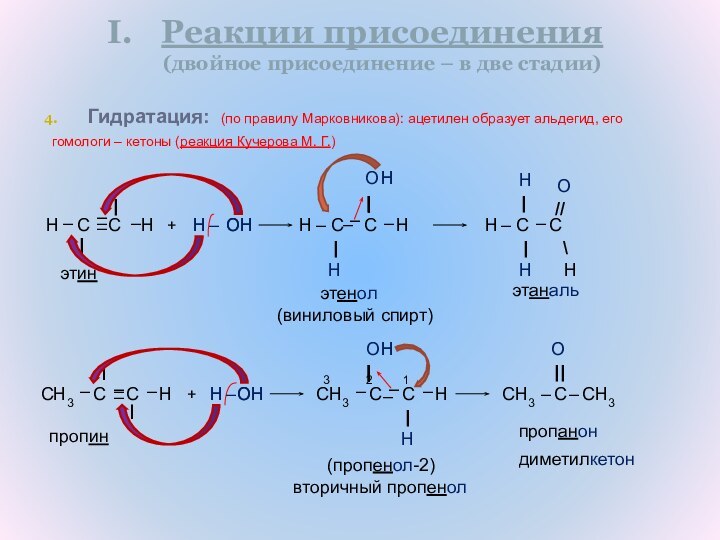
H – C ≡ C – H
Алкины
– это органические соединения,
углеводороды
непредельного
алифатического (ациклического) характера,
в молекуле которых между атомами углерода – одна тройная связь, и которые соответствуют общей формуле CnH2n-2.
Предельные
Ароматические
Непредельные
Ациклические
Карбоцик-лические
Гетероцик-лические
Алканы
Циклоалканы
Алкены
Алкадиены
Алкины
Циклоалкадиены
Циклоалкены
Циклоалкины
Арены
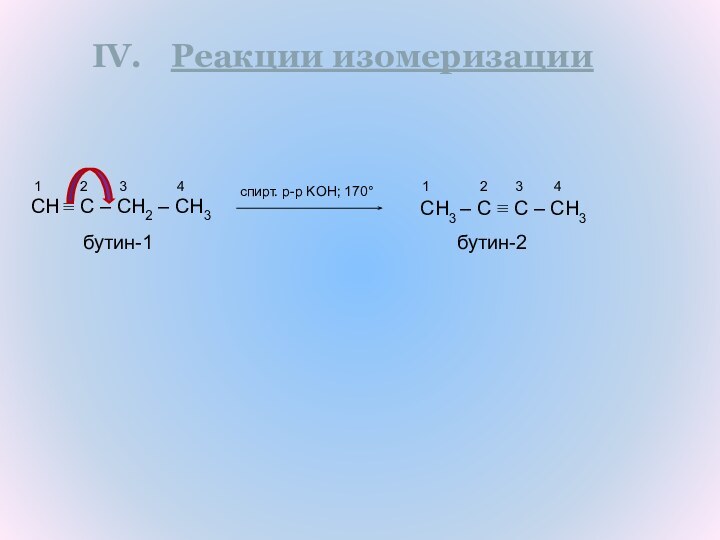
Алкины
Непредельные
Ациклические