на ней
Без теплоты, магнита, света
И электрических лучей?
Адам
МицкевичЭпиграф урока
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть






















Эпиграф урока
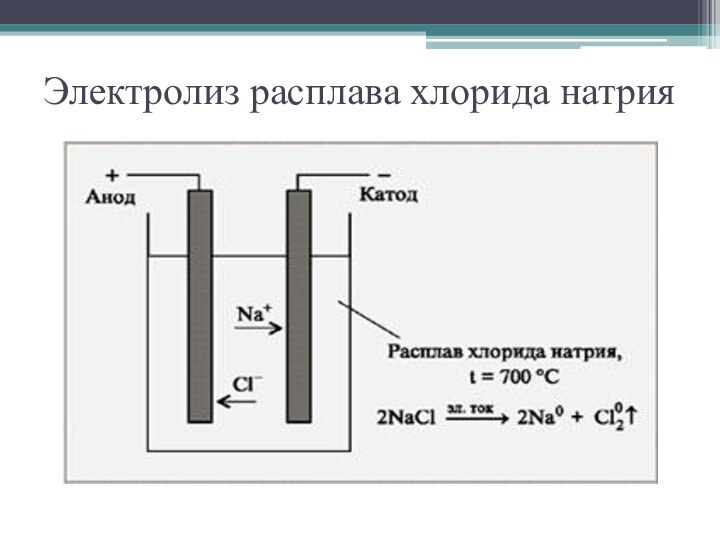
Расплав
NaCl
Катод(-) <- Na+ + Cl- -> Анод(+)
Na+ + e => Na0
2Cl- => Cl20 + 2e
Восстановление Окисление
2H2 О + 2e => H2 +
2Na+
2OH-
2 Cl- => Cl2 + 2e
Восстановление Окисление
Основные положения электродных процессов
1. На катоде:
Li, K+, Ca2+, Na+, Mg2+, Al3+
Zn2+, Cr3+, Fe2+, Ni2+, Sn2+, Pb2+
Cu2+, Ag+, Hg2+, Pt2+, Au3+
H+
Не восстанавливаются, выделяется H2
Возможно выделение Me и H2
Восстанавливаются, выделяется Me
2. Анодные процессы
а) Растворимый анод (Cu, Ag, Ni, Cd) подвергается окислению Me =>Men+ +ne
б) На нерастворимом аноде (графит, платина) обычно окисляются анионы S -, J-, Br-, Cl-, OH- и молекулы H20:
2J- =>J20 + 2e; 4OH- =>O2 +2H2O +4e; 2H2O =>O2 +4H+ +4e
Промышленный способ получения кислорода и водорода.
Оксидирование алюминия.
Электрополировка поверхностей (электроискровая обработка, электрозаточка).
Электрогравировка.