- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Фосфор и его соединения
Содержание
- 3. Фосфор и его соединения9 класс
- 4. Эпиграф О фосфор, ты наш лучший
- 5. Строение атомаПорядковый номер – 15Период – 3Группа – VНизшая СО - 3Высшая СО + 5
- 6. Открытие фосфора Х. Брантдом
- 8. Фосфор – простое вещество
- 9. Свойства аллотропных видоизменений фосфора
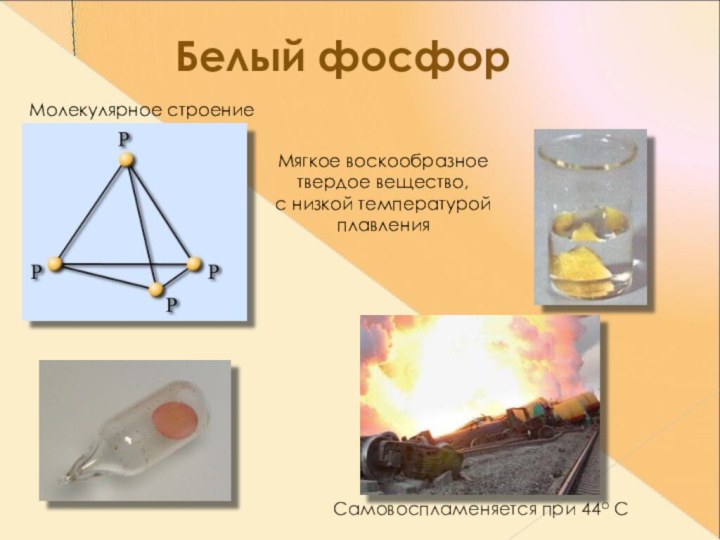
- 10. Белый фосфорМолекулярное строениеМягкое воскообразное твердое вещество, с низкой температурой плавленияСамовоспламеняется при 44о С
- 11. Светится в темноте
- 13. Красный фосфор Порошок красного цвета, гигроскопичен, не светится.Не ядовит
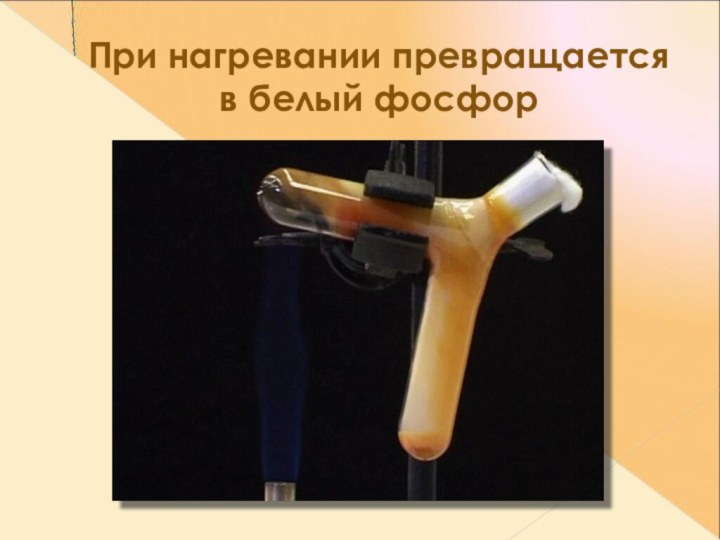
- 14. При нагревании превращается в белый фосфор
- 15. Черный фосфорТвердое вещество с металлическим блеском,жирное на ощупь, похожее на графит, полупроводник, малоактивен, практически негорюч
- 16. Химические свойстваВзаимодействует с металлами
- 17. Горит в кислороде
- 18. Соединения фосфораФосфинОксид фосфора (V) Ортофосфорная кислота
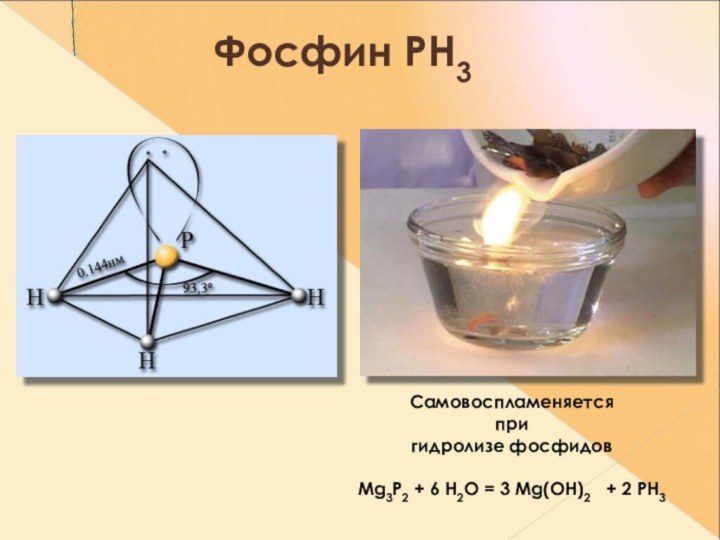
- 19. Фосфин РН3 Самовоспламеняется при гидролизе фосфидовMg3P2 + 6 H2O = 3 Mg(OH)2 + 2 PH3
- 20. Оксид фосфора (V) Р2О5Белый гигроскопичный порошок, хорошо растворяется в воде, является кислотным оксидом.
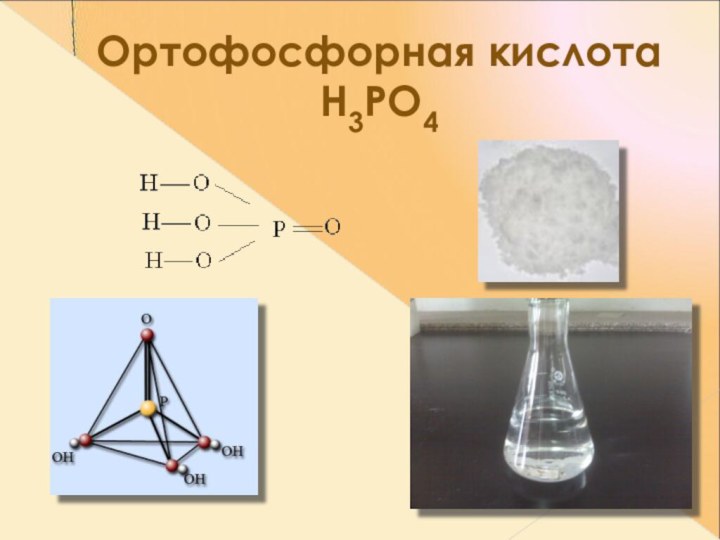
- 21. Ортофосфорная кислота Н3РО4
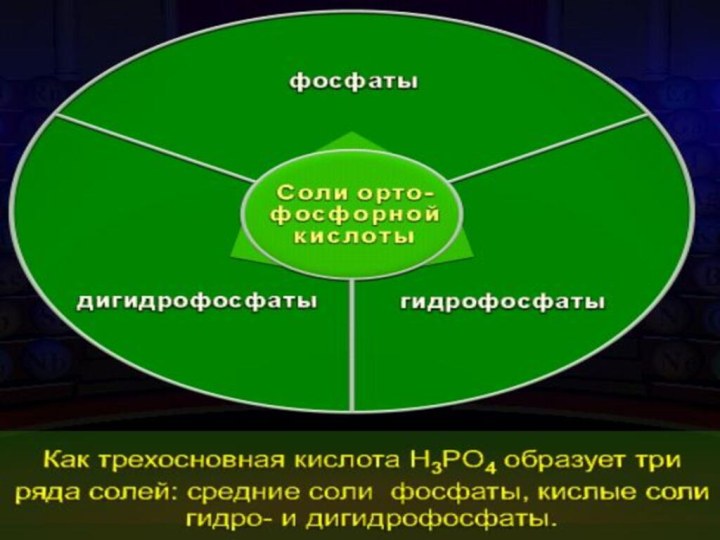
- 22. Качественная реакция на фосфат-ионРО43- + 3 Ag+ = Ag3PO4↓
- 24. Фосфор и здоровье человека Содержание фосфора
- 25. Продукты, содержащие фосфор
- 26. При избытке фосфора развивается мочекаменная болезньПри недостатке фосфора развивается рахит
- 27. Осторожно – фосфор!Летальная доза Р4 равна 60
- 28. Применение Производство спичекПроизводство минеральных удобренийПроизводство инсектицидов
- 29. История создания спичек
- 30. Фосфор и военное дело
- 31. Применение фосфорной кислоты
- 32. 1.Узнал много нового. 2. Мне это
- 33. Скачать презентацию
- 34. Похожие презентации
Фосфор и его соединения9 класс


























Слайд 10
Белый фосфор
Молекулярное строение
Мягкое воскообразное
твердое вещество,
с низкой
температурой
плавления
Самовоспламеняется при 44о С
Слайд 15
Черный фосфор
Твердое вещество с металлическим блеском,
жирное на ощупь,
похожее на графит,
полупроводник, малоактивен, практически негорюч
Слайд 16
Химические свойства
Взаимодействует с металлами
2Р + 3Са = Са3Р2 (фосфид кальция)
P + 3Na = Na3P (фосфид натрия)
Слайд 20
Оксид фосфора (V) Р2О5
Белый гигроскопичный порошок,
хорошо растворяется в воде, является кислотным оксидом.
Слайд 24
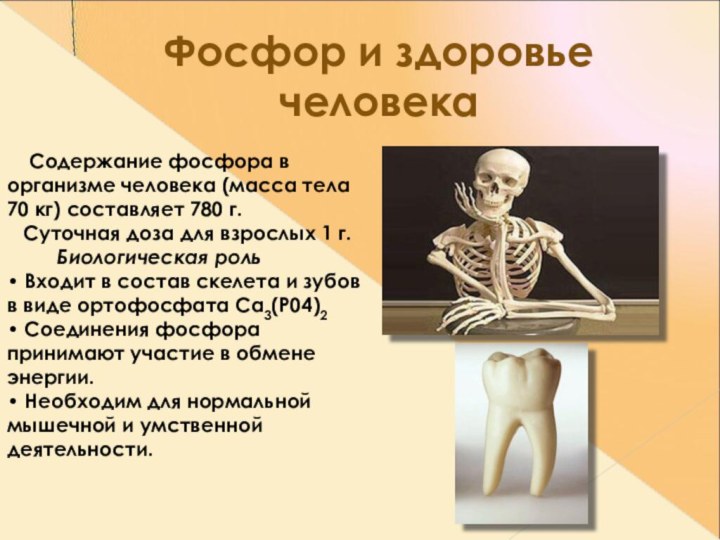
Фосфор и здоровье человека
Содержание фосфора в
организме человека (масса тела 70 кг) составляет 780 г.
Суточная доза для взрослых 1 г. Биологическая роль • Входит в состав скелета и зубов в виде ортофосфата Са3(Р04)2 • Соединения фосфора принимают участие в обмене энергии. • Необходим для нормальной мышечной и умственной деятельности.
Слайд 26
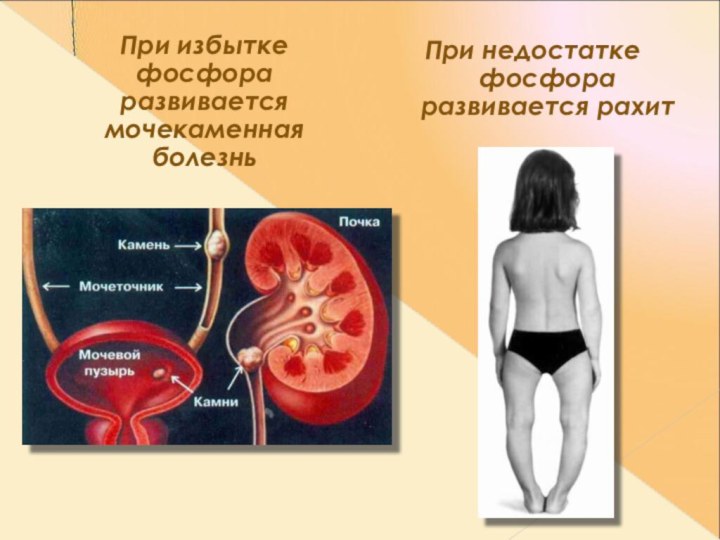
При избытке фосфора развивается мочекаменная болезнь
При
недостатке фосфора развивается рахит
Слайд 27
Осторожно – фосфор!
Летальная доза Р4 равна 60 мг.
Большую опасность представляют ожоги, возникающие при горении фосфора, из-за
выделения большого количества тепла при взаимодействии образующегося при горении Р2О5 с влагой кожи.Слайд 32 1.Узнал много нового. 2. Мне это пригодится в жизни. 3.
На поставленные вопросы я получил ответы. 4. На уроке работал
(с интересом, без удовольствия)и цели урока достигнуты.
Рефлексивный тест
(поставить + или -)