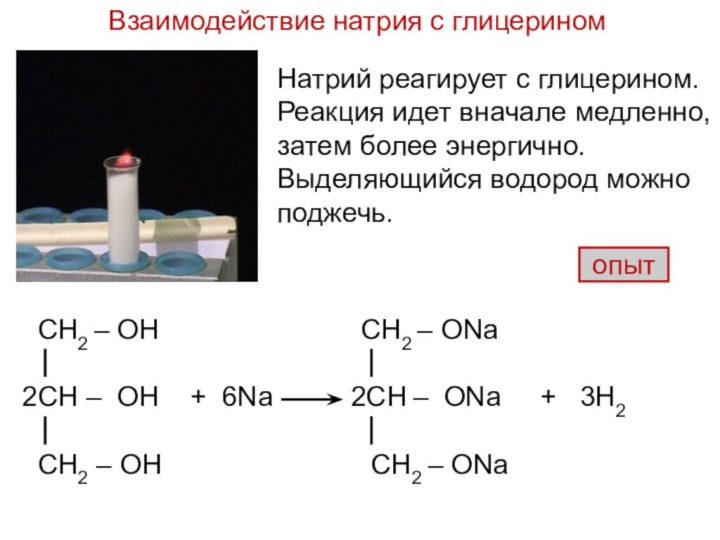
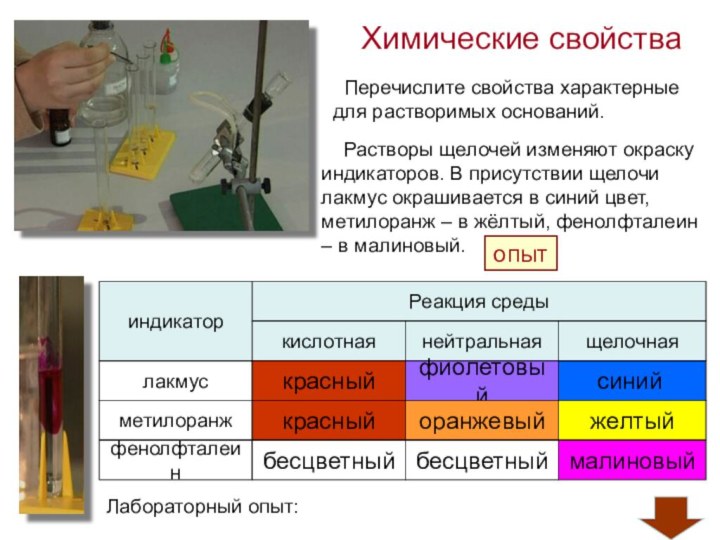
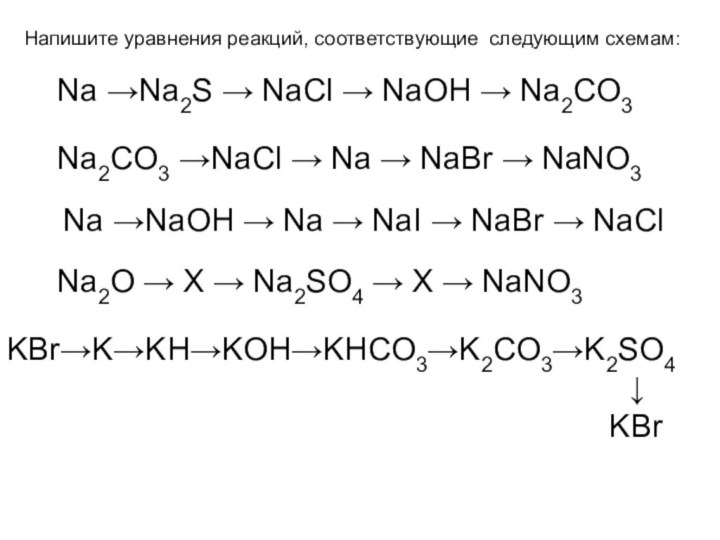
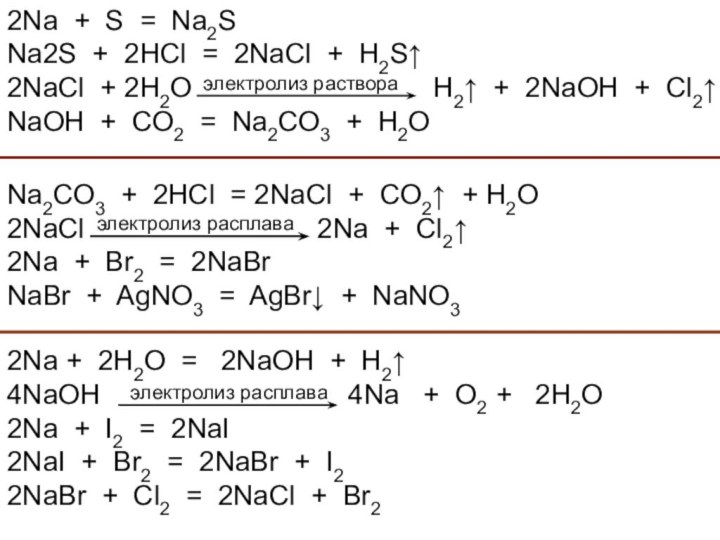
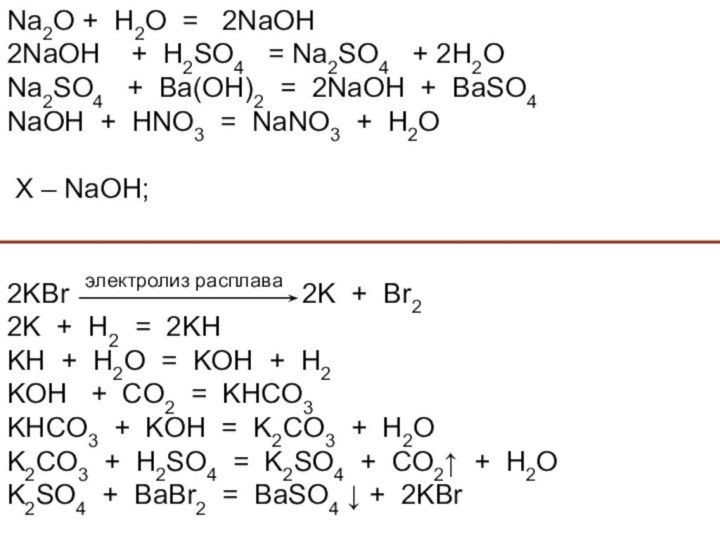
и используемого для замены обычного
дизельного топлива.
4
Полученный эфир (главным
образом линолевой
кислоты) отличается хорошей воспламеняемостью,
обеспечиваемой высоким цетановым числом.
Цетановое число условная количественная
характеристика самовоспламеняемости дизельных
топлив в цилиндре двигателя (аналог октанового
числа для бензинов). Если для минерального
дизтоплива характерен показатель в 50-52 %, то
метиловый эфир уже изначально соответствует
56-58 % цетана. Сырьем для производства
биодизеля могут быть различные растительные
масла: рапсовое, соевое и другие, кроме тех, в
составе которых высокое содержание пальмитино-
вой кислоты (пальмовое масло). При его производ-
стве в процессе этерификации также образуется
глицерин который используется в пищевой,
косметической и бумажной промышленности.
Получение биодизеля