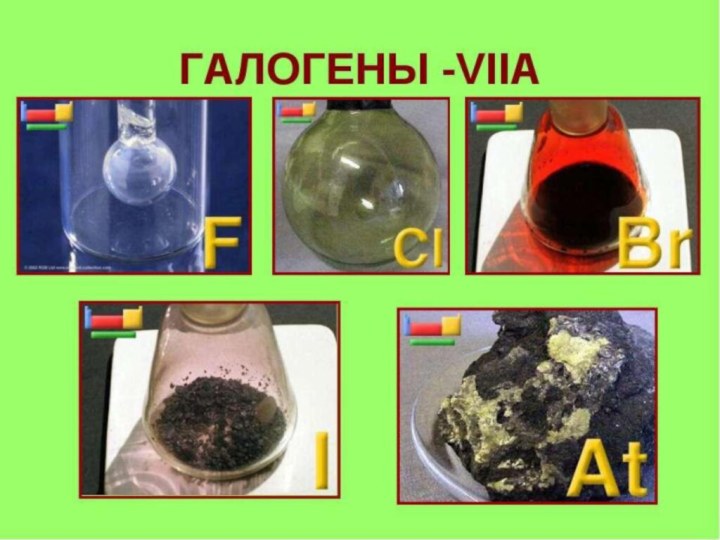
элементы главной подгруппыVIIгруппы периодической системы: фтор, хлор, бром, йод,
астат.Фтор
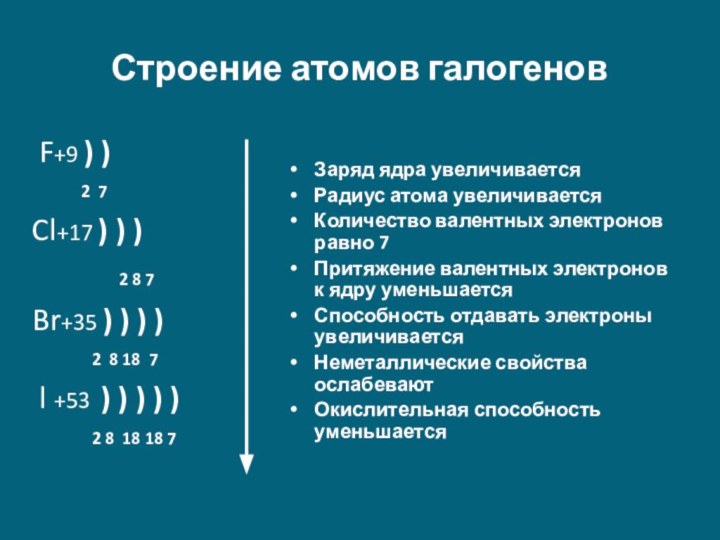
F +9)2)7 …2s22p5
Хлор
Cl +17)2)8)7 …3s23p5
Бром
Br +35)2)8)18)7 …4s24p5
Йод
I +53)2)8)18)18)7 …5s25p5
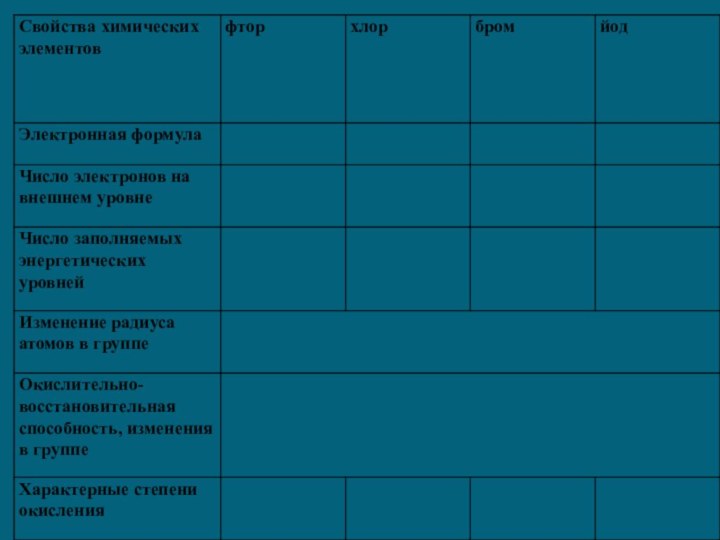
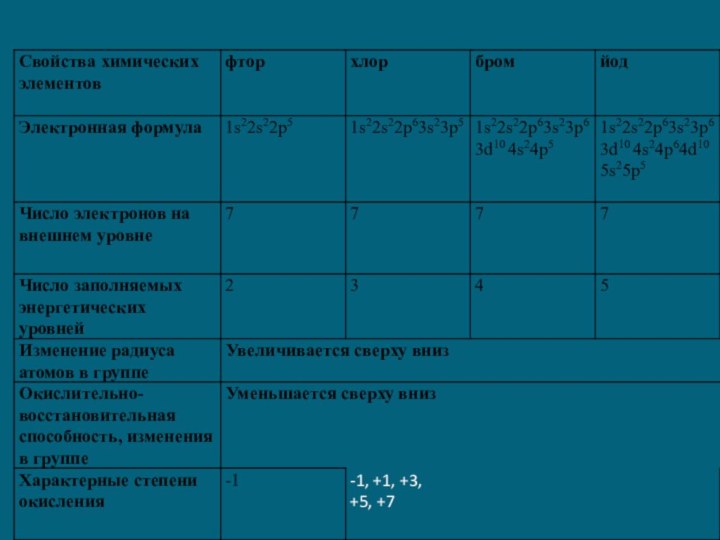
1) Общая электронная конфигурация внешнего энергетического уровня - nS2nP5.
2) С возрастанием порядкового номера элементов увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства (увеличиваются металлические свойства); галогены - сильные окислители, окислительная способность элементов уменьшается с увеличением атомной массы.
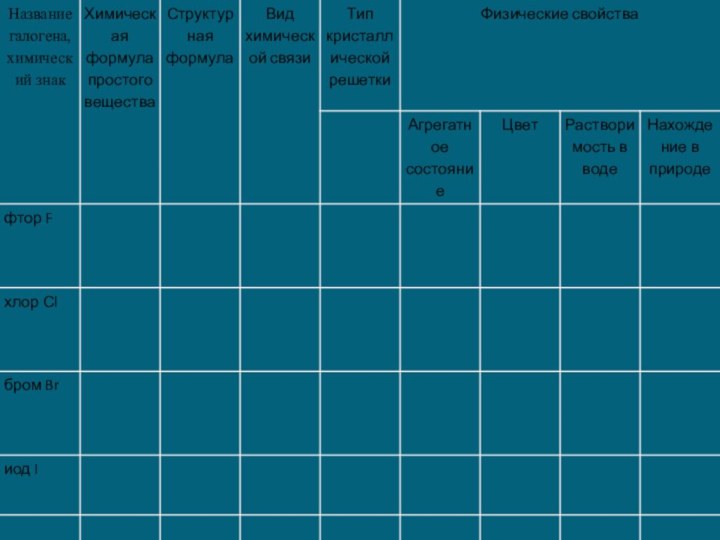
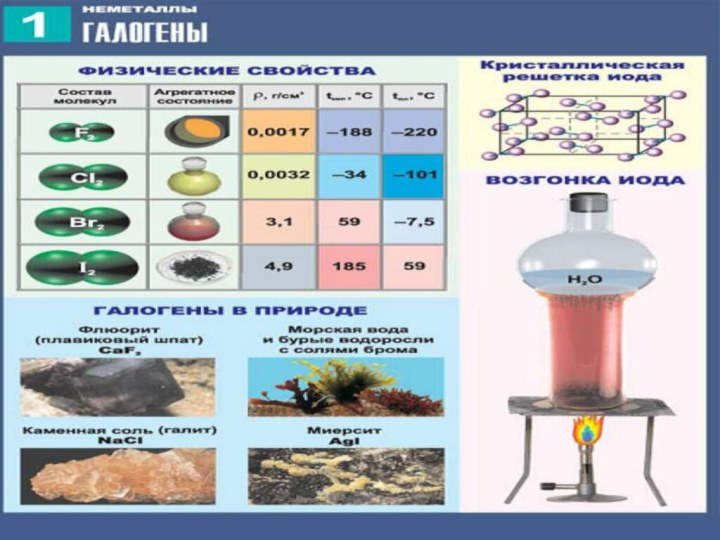
3) С увеличением атомной массы окраска становится более темной, возрастают температуры плавления и кипения, а также плотность.