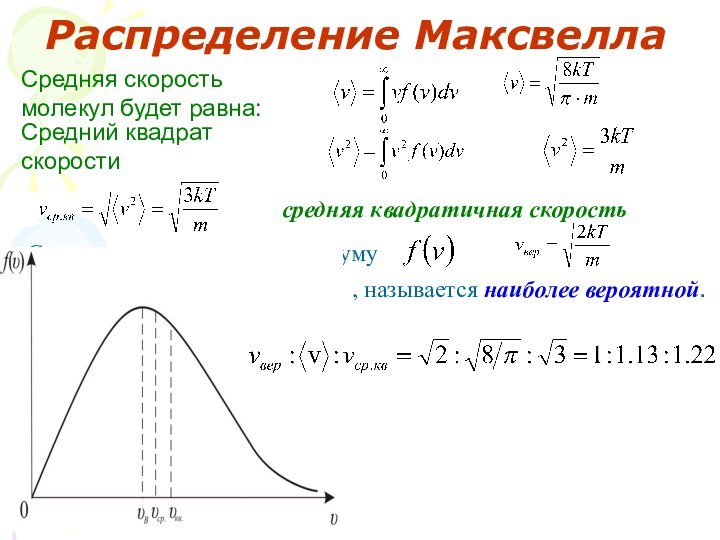
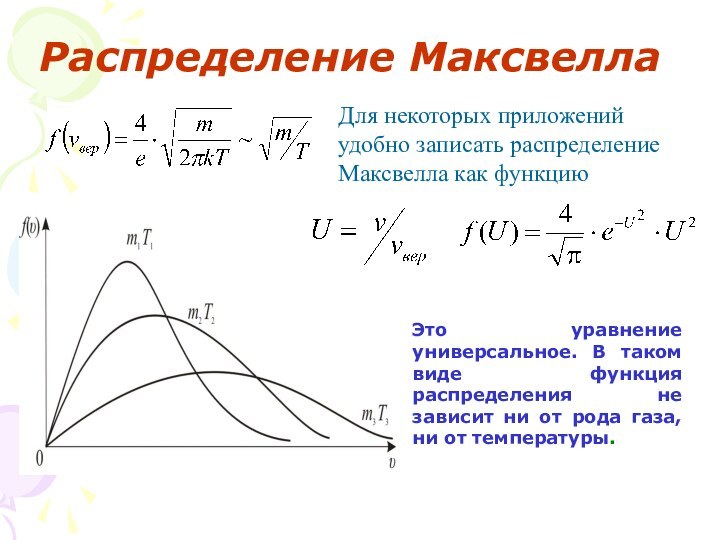
в зависимости от характера движения и взаимодействия частиц, образующих
тело.Термодинамика анализирует условия и количественные соотношения превращения энергии.
Её первоначальная задача – изучение закономерностей превращения тепла в работу (в тепловых машинах). Основным содержанием современной физической термодинамики является изучение закономерностей тепловой формы движущейся материи и связанных с ней физических явлений.