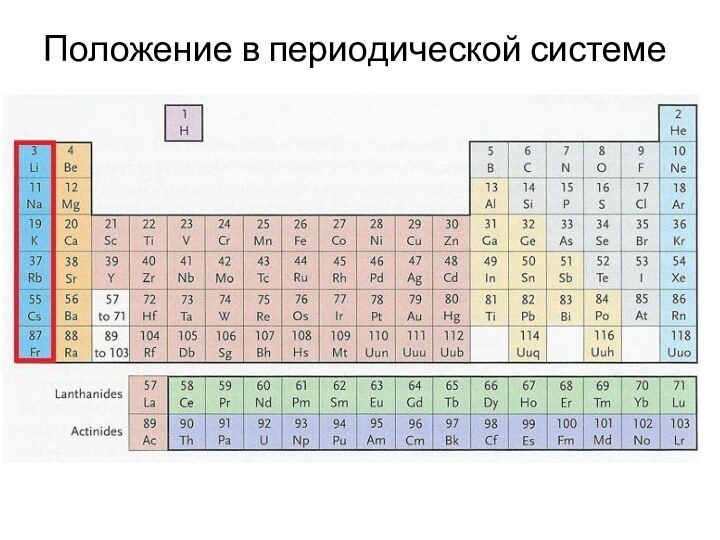
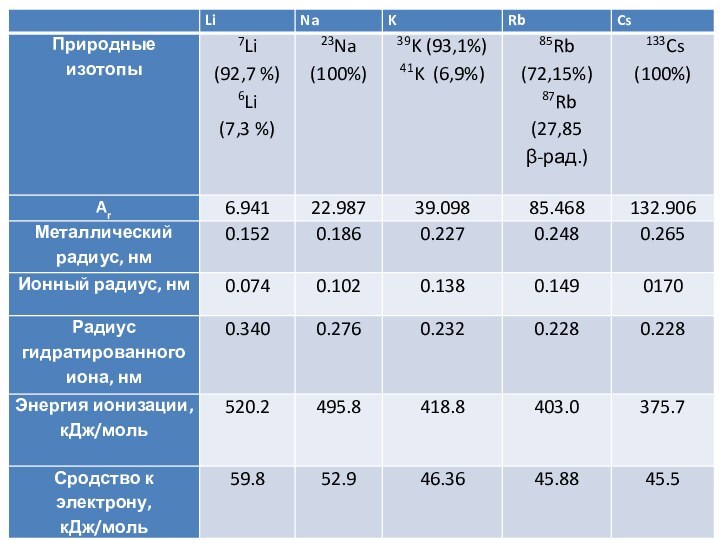
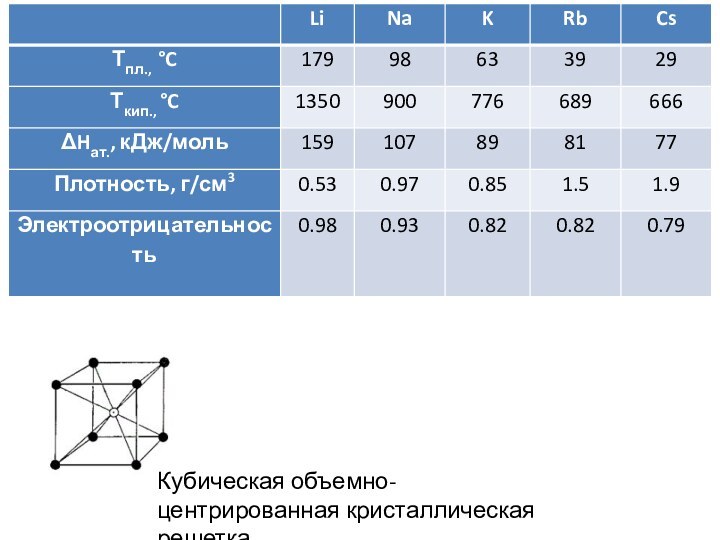
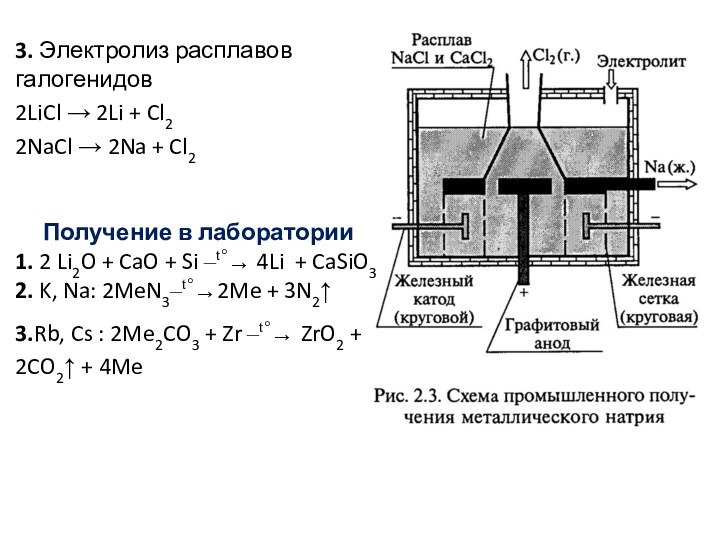
Г. Дэви
Na (лат. Natrium - «сода»; лат. Sodium -
«головная боль» ) 1807г. Г. ДэвиK (от араб. аль-кали — поташ). 1807г. Г. Дэви
Rb (от лат. Rubidium - красный) 1863г. Р. Бунзен
Cs (от лат. Caesium — небесно-голубой). 1860г. Р. В. Бунзен и Г. Р. Кирхгоф
Fr (от лат. Francium - Франция) 1939г. М. Пере
Гемфри Дэви
Р. Бунзен