- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему План лекции
Содержание
- 2. План лекцииСвойства идеальных и неидеальных растворов.Законы Дальтона
- 3. Свойства идеальных растворовСмешивание компонентов происходит без выделения
- 4. Системы с неограниченной взаимной растворимостью летучих компонентов
- 5. Насыщенный пар - пар, находящийся в равновесии
- 6. Дальтон (Dalton) Джон (1766-1844) английский химик и физик,
- 7. Закон ДальтонаОбщее давление пара над идеальным раствором
- 8. Закон Дальтонаhttp://www.internet-school.ru/ATTACH/8/71039.jpg
- 9. Франсуа Мари Рауль (1830-1901)— французский химик
- 10. Закон Рауля (1887 г) Парциальное давление
- 11. Общее давление пара над идеальным раствором:p =
- 12. Зависимость общего давления пара и парциального
- 13. Системы с «+» и «-» отклонением от
- 14. Системы с отклонениями от закона Рауля.«+» отклонение«-» отклонение
- 15. Системы с отклонениями от закона Рауля.
- 16. Типы диаграмм состояния неограниченно растворимых жидкостейДля изучения
- 17. Идеальный раствор
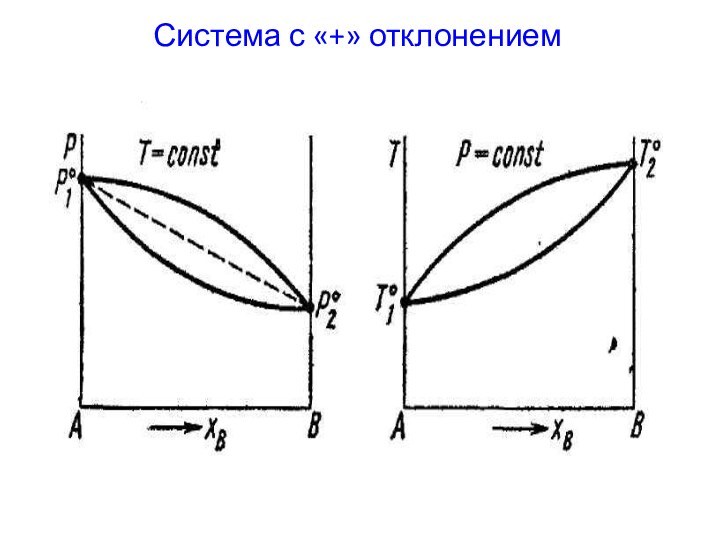
- 18. Система с «+» отклонением
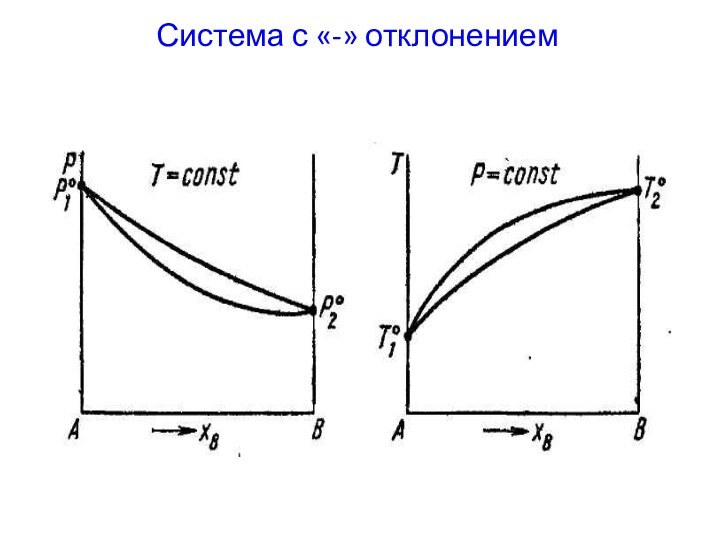
- 19. Система с «-» отклонением
- 20. Диаграмма p – состав (T=const)Состав жидкости составу пара!
- 21. Диаграмма Т – состав (р=const)
- 22. Первый закон Коновалова:пар по отношению к равновесной
- 23. Анализ диаграммы кипения
- 24. Список литературы1. Физическая и коллоидная химия: Учебник/Под
- 25. Скачать презентацию
- 26. Похожие презентации
План лекцииСвойства идеальных и неидеальных растворов.Законы Дальтона и Рауля.Диаграммы систем, подчиняющихся и не подчиняющихся закону РауляI закон Коновалова.



















Слайд 3
Свойства идеальных растворов
Смешивание компонентов происходит без выделения или
поглощения теплоты, т.е. ΔН= 0
Не происходит изменения объёмов, общий
V=ΣV компонентовVсм = VA+VB
3. Силы взаимодействия между разнородными и однородными молекулами равны:
FA-A = FA-B = FB-B
Не происходит изменения размеров частиц.
Теплота испарения каждого компонента из смеси такая же как и из чистого компонента.
Слайд 4
Системы с неограниченной взаимной растворимостью летучих компонентов
По характеру зависимости pнасыщ.пара –f(состав раствора) (при T=const) неограниченно
растворимые жидкости делятся на 3 вида:Идеальные, подчиняющиеся закону Рауля.
2) С “+” или “-” отклонением от закона Рауля, но без max или min на кривой зависимости pнасыщ.пара – состав раствора.
3) С “+” или “-” отклонением от закона Рауля, с max или min на кривой зависимости рнасыщ.пара - состав раствора.
Слайд 5 Насыщенный пар - пар, находящийся в равновесии с
жидкостью.
Давление насыщенного пара – давление пара, находящегося в равновесии
с жидкостью.
Слайд 6
Дальтон (Dalton) Джон (1766-1844)
английский химик и физик, создатель
химического атомизма. Установил (1803) закон кратных отношений, ввел понятие
«атомный вес», первым определил атомные веса (массы) ряда элементов. Открыл газовые законы, названные его именем. Первым (1794) описал дефект зрения, которым страдал сам, позже названный дальтонизмом.http://dic.academic.ru/pictures/enwiki/68/Dalton_John_desk.jpg
Слайд 7
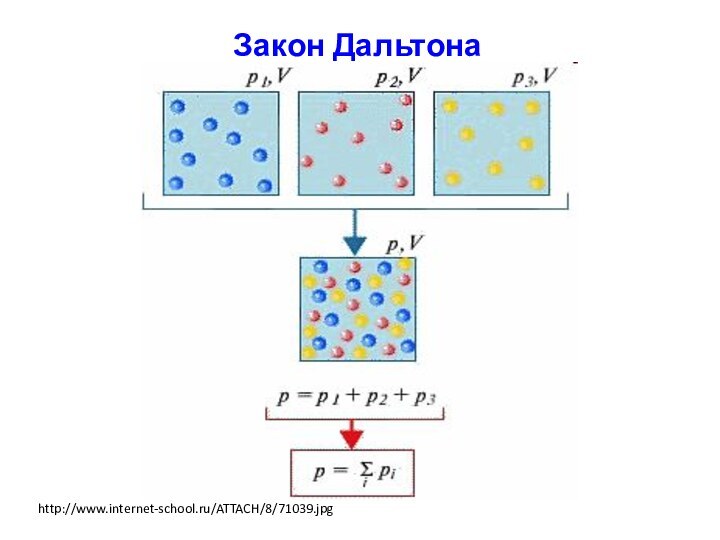
Закон Дальтона
Общее давление пара над идеальным раствором равно
сумме парциальных давлений насыщенного пара компонентов:
Pобщ = Σ Pi
Если оба компонента раствора летучи, то
p = pА +pВ
где pA – парциальное давление А,
pB – парциальное давление В
Слайд 9
Франсуа Мари Рауль
(1830-1901)
— французский химик и физик,
член-корреспондент Парижской АН (1890). С 1867 — в Гренобльском
университете (профессор с 1870). Член-корреспондент Петербургской АН (1899). Исследуя в 1882—88 понижение температуры кристаллизации, а также понижение давления пара (или повышение температуры кипения) растворителя при введении в него растворённого вещества, открыл закон Рауля, применяемый для определения молекулярных масс веществ в растворённом состоянии.http://www.physchem.chimfak.rsu.ru/Source/History/Persones/photos/Raoult.jpg
Слайд 10
Закон Рауля (1887 г)
Парциальное давление насыщенного
пара компонента над раствором прямопропорционально мольной доле вещества в
растворе:pА = pА0 χА и pВ = pВ0 χВ
pA0, pB0 – давления насыщенного пара над чистыми компонентами
(при T=const)
Слайд 11
Общее давление пара над идеальным раствором:
p = pА
+ pВ = pА0χВ + pВ0 χВ
χА+ χВ
=1p = pА0 (1-В) + pВ0В = pА0 + (pВ0 - pА0)В
Вывод: парциальное давление пара компонентов раствора, а также общее давление пара над идеальным раствором линейно зависят от состава раствора.
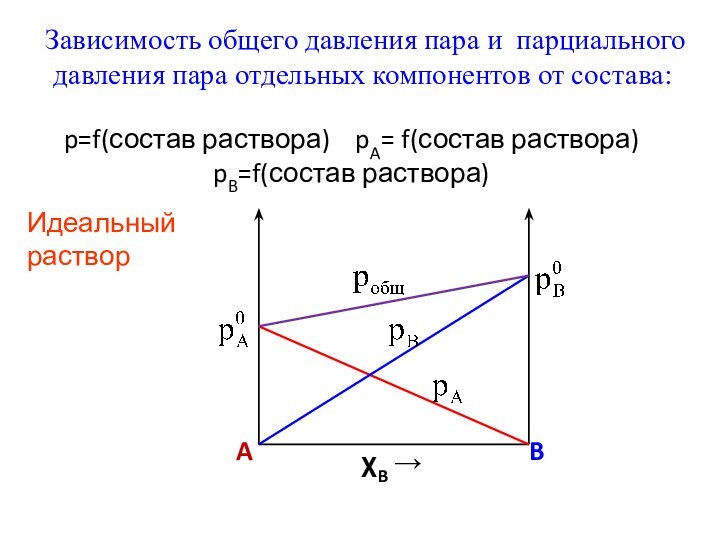
Слайд 12 Зависимость общего давления пара и парциального давления
пара отдельных компонентов от состава:
p=f(состав раствора) pA= f(состав
раствора) pB=f(состав раствора)Идеальный раствор
Слайд 13
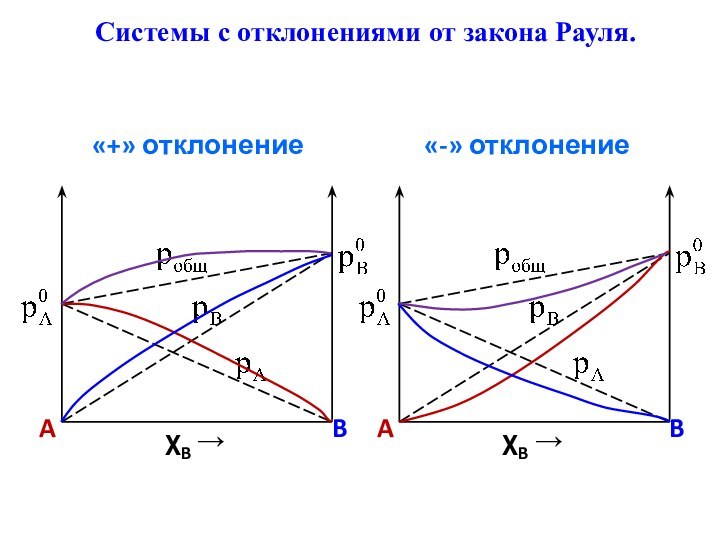
Системы с «+» и «-» отклонением от идеальности.
«+»
отклонения – давление пара над реальным раствором больше, чем
над идеальным раствором такого же состава.«-» отклонения – давление пара над реальным раствором меньше, чем над идеальным раствором такого же состава.
Знак и величина отклонения зависят от природы компонентов раствора.
Слайд 16
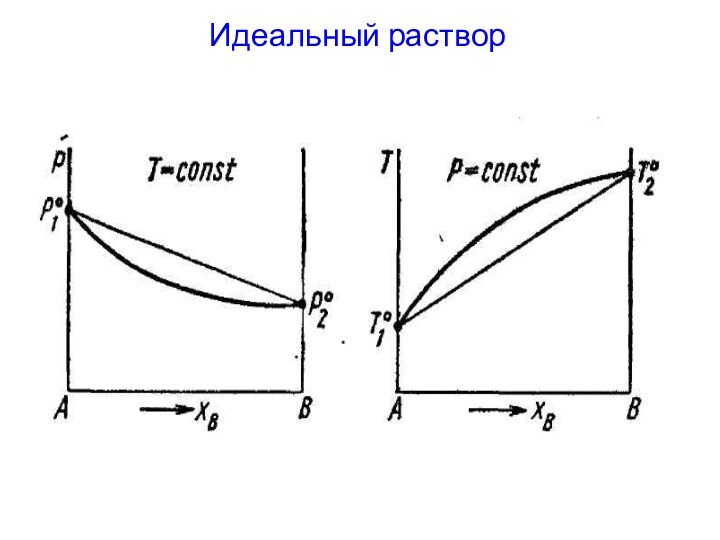
Типы диаграмм состояния неограниченно растворимых жидкостей
Для изучения равновесия
пар ⇆ раствор:
1) Давление пара - состав раствора (T=const)
2)
Температура кипения – состав раствора (р=const)В общем случае (исключая азеотроп):
Состав пара отличается от состава жидкого раствора, из которого он получен.
Слайд 22
Первый закон Коновалова:
пар по отношению к равновесной жидкой
фазе обогащен тем компонентом, добавление которого к жидкости увеличивает
давление насыщенного пара или понижает температуру кипения.
Слайд 24
Список литературы
1. Физическая и коллоидная химия: Учебник/Под ред.
Проф. А.П. Беляева. - М.: ГЭОТАР-Медиа, 2008.-704с.
2. Физическая химия.
В 2 кн. Кн.1/Под ред. К.С. Краснова - М: Высшая школа, 2001.-512с.3. Стромберг А.Г., Семченко Д.П. Физическая химия. М : Высшая школа, 1999 .
4. Голиков Г.А. Руководство по физической химии. М.: Высшая школа, 1988





























