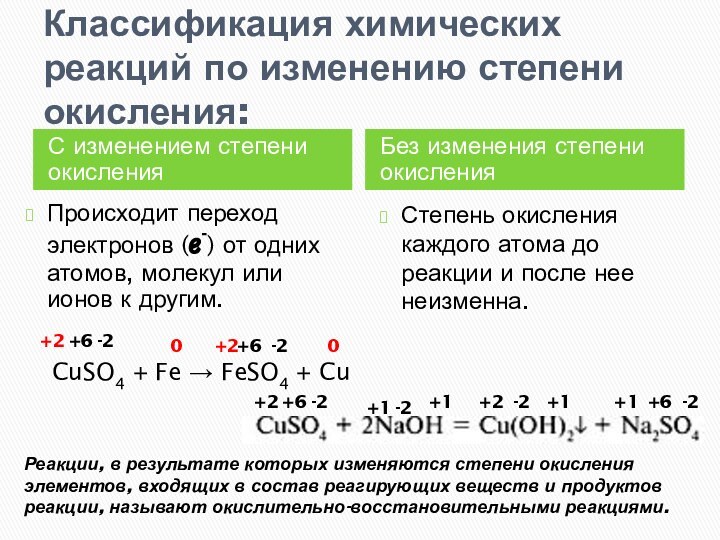
степени окисления
Без изменения степени окисления
Происходит переход электронов (ℯ-) от
одних атомов, молекул или ионов к другим.Степень окисления каждого атома до реакции и после нее неизменна.
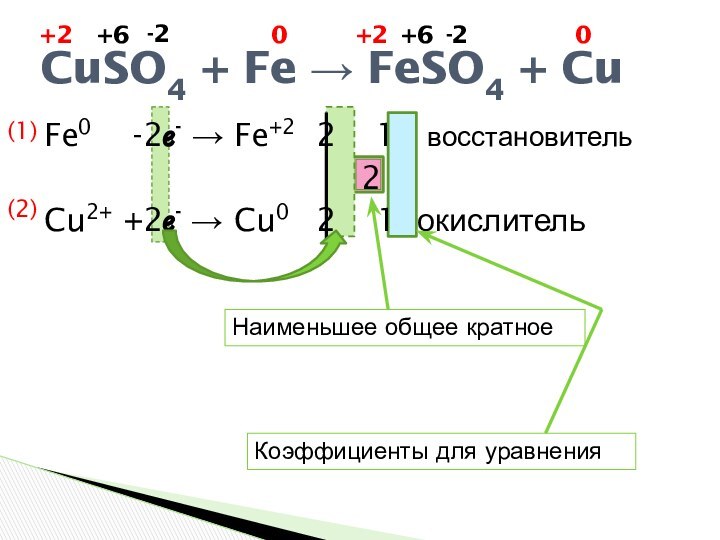
CuSO4 + Fe → FeSO4 + Cu
+2
+6
-2
0
+2
+6
-2
0