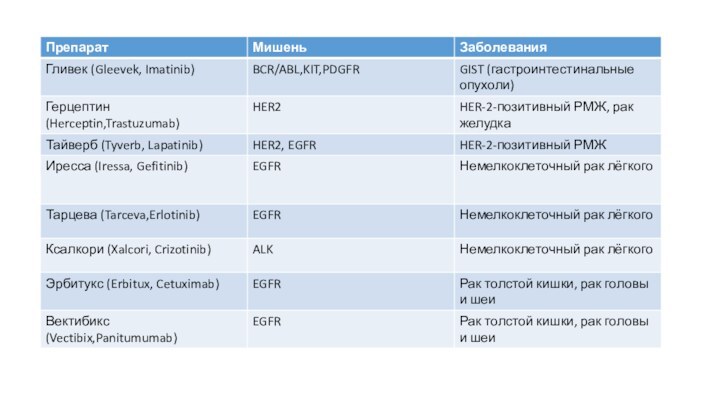
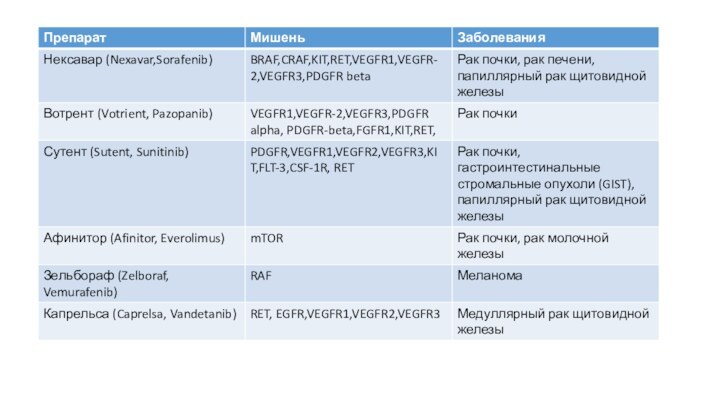
Слайд 2
Р А К – заболевание генетического аппарата клетки,
при котором происходит переключение генетической программы регулируемой клеточной гибели
(апоптоз) на программу бесконтрольного клеточного деления
Это переключение возможно в результате появления в клетках генетических и эпигенетических изменений
Слайд 3
Термин «молекулярная онкология»
Разработка метода лечения в соответствии с
генетическими характеристиками раковых клеток
С учетом разработок в области молекулярной
онкологии возможно прогнозирование течения рака, наблюдение за эффективностью лечения и ранняя диагностика
Значительное развитие молекулярной онкологии произошло после внедрения в практику методов молекулярной генетики
Слайд 4
Основные постулаты вирусно-генетической теории происхождения опухолей (Л.А. Зильбер,
1968)
Естественно возникающие опухоли вызываются вирусами
Опухолевая конверсия клеток вызывается не
вирусом, а его нуклеиновой кислотой.
Новая генетическая информация, приносимая нуклеиновой кислотой вируса в клетку, инкорпорируется частично или полностью в геном клетки.
В результате наследственных изменений возникает нерегулируемое размножение клеток, приводящее к образованию опухоли.
Вирус, вызвавший опухолевую конверсию, не принимает участия в размножении уже образовавшихся опухолевых клеток.
«Рак – это заболевание генома клетки»
Молекулярная онкология: от вирусной теории к лечению рака
Слайд 6
Первые этапы молекулярной онкологии (1970 –1980 гг)
Обнаружение онкогена
в РНК вируса саркомы птиц Рауса.
Доказательства необходимости ДНК для
репликации вируса (инфекционность ДНК из зараженных клеток).
Обнаружение обратной транскриптазы в вирионах
Продукт онкогена–белок, обладающий фосфотирозин-киназной активностью
Идентификация онкогенов во всех РНК-содержащих вирусах с трансформирующим потенциалом.
Создание экспериментальных моделей–клетки млекопитающих, трансформированные вирусом саркомы Рауса
Выявление гомологов онкогенов (протоонкогенов) в нормальных клетках
Слайд 7
Ключевые гены, контролирующие пролиферацию клеток
ОНКОГЕНЫ – клеточные

или вирусные гены, экспрессия которых ведет к развитию новообразований.
ПРОТООНКОГЕНЫ
(стимулируют пролиферацию).
Чтобы отличать нормальные гены от вирусных онкогенов, для первых было введено название протоонкогены. В группу протоонкогенов вошли гены, кодирующие белки, которые играют центральную роль в регуляции процессов роста и развития организма, такие как факторы роста (ФР), рецепторы ФР, транскрипционные факторы и белки, вовлечённые в трансдукцию сигналов
ГЕНЫ-СУПРЕССОРЫ (подавляют пролиферацию).
Опухолевые супрессоры (антионкогены) - клеточные гены, инактивация которых резко увеличивает вероятность возникновения новообразований, а восстановление функции, наоборот, может подавить рост опухолевых клеток. Следует заметить, что причисляемые к опухолевым супрессорам так называемые "мутаторные" гены, т.е. гены, нарушения функции которых тем или иным способом увеличивает темп возникновения мутаций и/или других генетических изменений, могут и не влиять на рост неопластических клеток. Однако их инактивация столь сильно увеличивает вероятность появления различных онкогенных мутаций, что образование опухоли становится лишь делом времени.
ГЕНЫ, КОНТРОЛИРУЮЩИЕ КЛЕТОЧНЫЙ ЦИКЛ
(циклины и циклин-зависимые киназы-Cdk и их ингибиторы)
Слайд 8
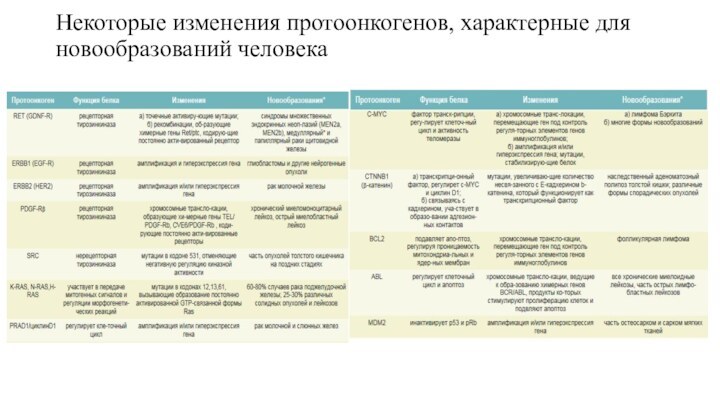
Некоторые изменения протоонкогенов, характерные для новообразований человека
Слайд 9
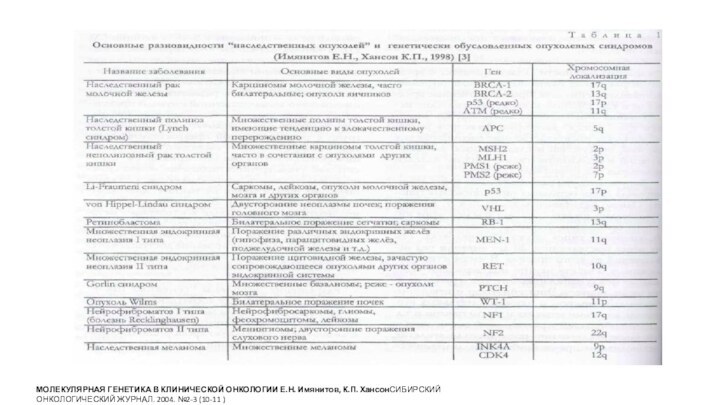
Формы опухолей человека, возникающие при инактивации некоторых опухолевых
супрессоров и мутаторных генов
*Подчеркнуты наследственные формы заболеваний, возникающие при
мутациях в половых клетках.
** Локус INK4a/ARF кодирует два белка: p16INK4a - ингибитор циклинзависимых киназ Cdk4/6 и p19ARF (Alternative Reading Frame) - продукт альтернативной рамки считывания, который, связывая р53 и Mdm2, блокирует их взаимодействие и препятствует деградации р53 . Делеции и многие точечные мутации в локусе INK4a/ARF вызывают одновременно инактивацию супрессорных активностей обоих этих белков .
Механизмы действия онкогенов и опухолевых супрессоров.
Обзор Копнин Б.П.НИИ канцерогенеза, Российский Онкологический научный центр, РАМН
Слайд 10
МОЛЕКУЛЯРНАЯ ГЕНЕТИКА В КЛИНИЧЕСКОЙ ОНКОЛОГИИ Е.Н. Имянитов, К.П.
ХансонСИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2004. №2-3 (10-11 )
Слайд 11
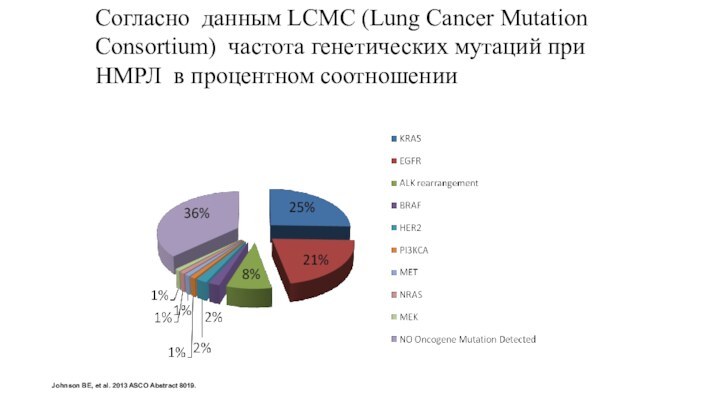
Johnson BE, et al. 2013 ASCO Abstract 8019.
Согласно
данным LCMC (Lung Cancer Mutation Consortium) частота генетических мутаций
при НМРЛ в процентном соотношении:
Слайд 12
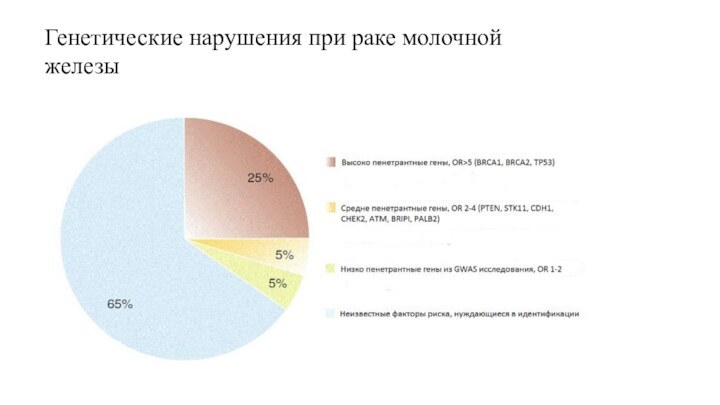
Генетические нарушения при раке молочной железы
Слайд 13
Молекулярная диагностика в онкологии
Начиная с последнего десятилетия ХХ
века мы являемся свидетелями огромного технологического скачка в молекулярной
биологии и генетике.
В настоящее время появились методы, позволяющие одновременно анализировать целый спектр биомолекул. Современные технологии делают возможным детекцию повреждений ДНК практически любого масштаба – от крупных хромосомных аномалий до однонуклеотидных замен; кроме того, можно оценить влияние тех или иных мутаций на уровне РНК и белка. В практическом смысле это привело к чрезвычайному расширению возможностей молекулярной диагностики.
Слайд 14
Медицинская генетика
Задача медицинской генетики - выявление генетического повреждения,

лежащего в основе патогенеза той или иной болезни.
В
первую очередь к сфере интересов генетиков относятся хромосомные и генные (моногенные) заболевания.
Основные виды хромосомных повреждений: делеции, дупликации, инсерции и транслокации. Традиционно для детекции таких нарушений используются цитогенетические (кариотипирование) или молекулярно-цитогенетические (флуоресцентная гибридизация in situ, сравнительная геномная гибридизация) методы.
К менее масштабным повреждениям (мутациям), затрагивающим ген или его часть, относятся точковые мутации. «Золотым стандартом» диагностики в этом случае является ПЦР с последующим ДНК-секвенированием. Генетические нарушения могут передаваться по наследству или возникать de novo – в последнем случае семейный анамнез по данному заболеванию не отягощен.
«ПРИМЕНЕНИЕ МОЛЕКУЛЯРНЫХ ТЕХНОЛОГИЙ НОВОГО ПОКОЛЕНИЯ В МЕДИЦИНСКОЙ ГЕНЕТИКЕ»
Научно-образовательный курс Суспицын Е.Н., Санкт_петербург,2013
Слайд 15
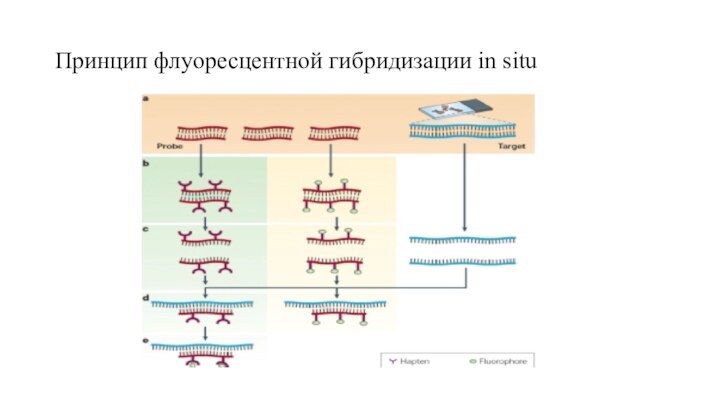
FISH, флуоресцентная гибридизация in situ
FISH, флуоресцентная гибридизация in

situ – техника, впервые возникшая в 1969 году, использует
гибридизацию флуоресцентно меченых ДНК-проб на цитогенетическом препарате.
Проведение такого анализа требует синтеза пробы (зонда), комплементарного интересующему нас участку хромосомы. ДНК проба (зонд) метится флуоресцентными красителем. Существуют две стратегии мечения: прямое и непрямое. Для непрямого мечения пробы метят модифицированными нуклеотидами, содержащими гаптен. Меченая проба и ДНК-матрица подвергаются денатурации, после этого проба по принципу комплементарности присодиняется к соответствующему участку ДНК
Если проба была мечена непрямым способом, то необходим дополнительный шаг визуализации гаптена с помощью специальных ферментных или иммунологических систем. Непрямое мечение позволяет усилить исходный сигнал, сделав его более ярким по сравнению с фоном. Повышение разрешающей способности данного метода, с одной стороны, связано с улучшением эффективности мечения и качества зондов. С другой стороны, совершенствуется этап подготовки хромосомного препарата. Для сравнения, разрешение метафазной FISH – порядка 5 Мб, FISH на интерфазных ядрах – 50 Кб-2Мб.
Слайд 16
Принцип флуоресцентной гибридизации in situ
Слайд 17
Экспрессионные профили (expression arrays)
В конце 1990-х годов
появилась техническая возможность создания «экспрессионных портретов» различных тканей и
клеток. Известно, что всех клетки организма содержат одинаковый набор генов, однако для разных тканей и органов характерны различные паттерны экспрессии. Возможен анализ экспрессионных профилей на уровне протеинов (protein microarrays), однако наибольшее распространение получили технологии, основанные на изучении мРНК.
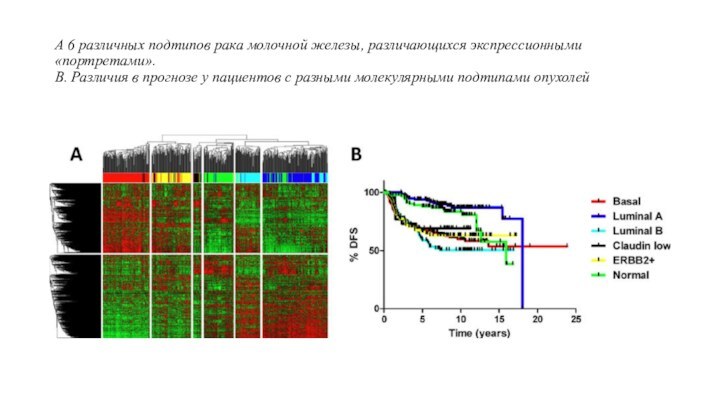
В частности, экспрессионные микрочипы позволили классифицировать рак молочной железы на несколько основных молекулярных подтипов (базальный, люминальный, HER2-позитивный и т.д.), различающихся по клиническим и биологическим характеристикам. Коммерческий микрочип, содержащий гибридизационные пробы к 70 генам (MammaPrint компании Agendia), позволяет оценить риск метастазирования инвазивных карцином молочной железы.
Слайд 18
А 6 различных подтипов рака молочной железы, различающихся
экспрессионными «портретами».
В. Различия в прогнозе у пациентов с
разными молекулярными подтипами опухолей
Слайд 19
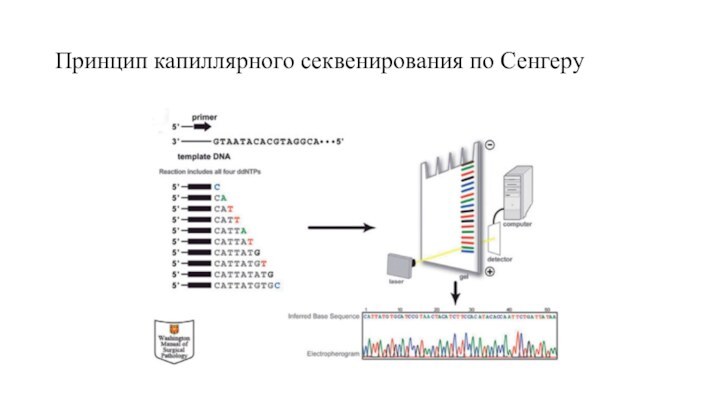
Секвенирование ДНК
Вплоть до настоящего времени «золотым стандартом»

ДНК-диагностики остается традиционное секвенирование. Принцип этого метода был разработан
Ф. Сэнгером в конце 1970-х годов и подразумевает использование модифицированных нуклеотидов – дидезоксинуклеотидтрифосфатов (ddNTP), или терминаторов. Наиболее распространенным методом анализа нуклеотидной последовательности является секвенирование с использованием капиллярных генетических анализаторов Как правило, сначала производится ПЦР-амплификация фрагмента ДНК, содержащего интересующую последовательность. К полученному продукту добавляют прямой или обратный праймер и ДНК-полимеразу. В ходе реакции ДНК-полимераза встраивает в растущую цепь ДНК терминирующий нуклеотид, который прекращает синтез после соответствующей «буквы». В результате образуется большое число фрагментов ДНК, отличающихся по длине на один нуклеотид. Терминаторы помечены четырьмя различными флуоресцентными красителями. Фрагменты ДНК движутся в тонком капилляре, заполненном полиакриламидным гелем, и разделяются в соответствии с их длиной. Флуоресцентный сигнал от каждого терминирующего нуклеотида детектируется с помощью лазера и преобразуется в хроматограмму – графическое изображение нуклеотидной последовательности, где каждый нуклеотид представлен в виде пика соответствующего цвета (красный, синий, зеленый, черный). К недостаткам капиллярного секвенирования можно отнести высокую стоимость реагентов, а также невысокую производительность.
Слайд 20
Принцип капиллярного секвенирования по Сенгеру
Слайд 21
Секвенирование нового поколения (NGS)
Важнейшим технологическим прорывом в молекулярной

медицине стало появление так называемого секвенирования нового поколения (NGS,
Next Generation Sequencing; massive parallel sequencing). Данный термин объединяет группу подходов, предложенных различными фирмами (Roche, Illumina, Life Technologies), и основанных на одновременном параллельном секвенировании миллионов коротких фрагментов ДНК с последующей «сборкой» генома. Сравнение результатов анализа с референсной последовательностью позволяет выявить практически любые виды мутаций в масштабах всего генома или отдельных его частей. Полногеномное секвенирование (WGS, Whole Genome Sequencing) дает возможность одномоментного анализа всех известных на сегодняшний день генов. В ходе экзомного секвенирования (exome capture sequencing) производится «захват» (capture) и обогащение исключительно кодирующих последовательностей генома
Несмотря на свою недолгую историю, секвенирование нового поколения хорошо зарекомендовало себя в качестве мощного инструмента медицинской генетики, позволив обнаружить гены, причастные к развитию многих редких заболеваний
Диагностическое применение полногеномного секвенирования пока ограничивается высокой стоимостью анализа, необходимостью приобретения дорогостоящего оборудования и сложностью биоинформатической обработки огромного массива полученных данных.
Слайд 22
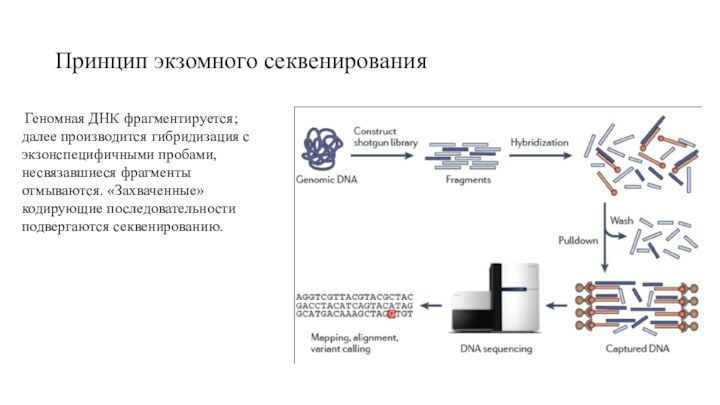
Принцип экзомного секвенирования
Геномная ДНК фрагментируется; далее производится
гибридизация с экзонспецифичными пробами, несвязавшиеся фрагменты отмываются. «Захваченные» кодирующие
последовательности подвергаются секвенированию.
Слайд 23
Прибор для полногеномного секвенирования HiSeq2000
фирмы Illumina.
Слайд 24
Экзомное (полноэкзомное) секвенирование
Значительно лучшие перспективы внедрения имеет экзомное
(полноэкзомное) секвенирование, подразумевающее анализ лишь небольшой части (около 1%)
генома. Известно, что подавляющее большинство генетических заболеваний связано с мутациями в участках ДНК, кодирующих синтез белков, поэтому анализ экзома, по-видимому, достаточен для детекции подавляющего большинства патогенных мутаций Крайне важно, что использование экзомного секвенирования позволяет производить диагностический поиск без четкой предварительной гипотезы, т.е., является наиболее оправданным в тех случаях, когда установление диагноза на основании клинических признаков и результатов традиционных исследований (биохимия, кариотипирование, FISH, отдельные молекулярно-генетические тесты) затруднительно
Слайд 25
Развитие технологии ПЦР
История применения ПЦР насчитывает уже

более 25 лет, и за это время метод доказал
свою незаменимость в молекулярно-генетических исследованиях. Вначале технология подразумевала детекцию продукта путем гель-электрофореза; затем появилась так называемая ПЦР в реальном времени (real time PCR), основанная на применении флуоресцентных красителей или флуоресцентно-меченных проб. Последний подход обладает рядом преимуществ перед «классической» ПЦР/
Во-первых, возможен не только качественный, но и количественный анализ – например, детекция амплификаций или измерение экспрессии генов.
Во-вторых, за счет того, что оценка результатов основана на повышении уровня флуоресценции и проводится на компьютере, время диагностики существенно сокращается, фактически сводясь к времени осуществления самой реакции (2-2,5 часа).
В- третьих, анализ проводится в закрытых пробирках, что позволяет минимизировать опасность получения ложноположительных результатов вследствие контаминации (загрязнения) продуктами предыдущих реакций.
Появление технологий real-time вдохнуло новую жизнь в методику аллель-специфической ПЦР. Этот подход подразумевает использование в реакции трех праймеров, один из которых распознает мутантный аллель, другой – специфичен для нормальной последовательности, а третий –является общим. Техническая простота и невысокая стоимость аллель-специфической ПЦР в реальном времени определяют её широкое использование для детекции мутаций
Слайд 26
Пример использования аллель-специфической ПЦР-РВ для диагностики мутаций. Слева
– гетерозигота (соотношение нормального и мутантного аллеля 1:1); справа
– нормальная гомозигота (отмечается поздняя неспецифическая амплификация мутантного аллеля)
Слайд 27
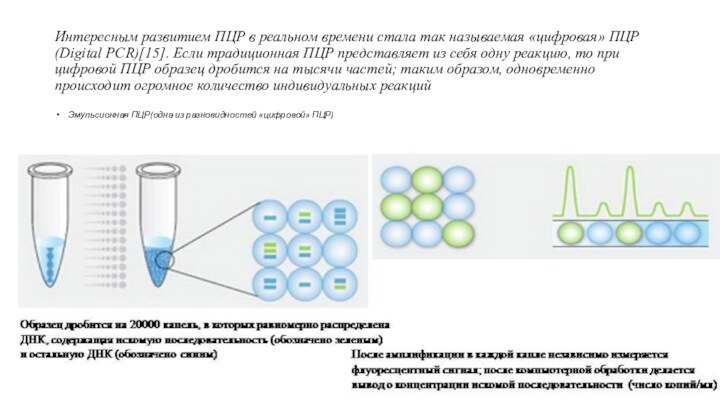
Интересным развитием ПЦР в реальном времени стала так
называемая «цифровая» ПЦР (Digital PCR)[15]. Если традиционная ПЦР представляет
из себя одну реакцию, то при цифровой ПЦР образец дробится на тысячи частей; таким образом, одновременно происходит огромное количество индивидуальных реакций
Эмульсионная ПЦР(одна из разновидностей «цифровой» ПЦР)
Слайд 28
Эра таргетной терапии и персонализации в лечении онкологических
заболеваний
Слайд 29
Стратегии противоопухолевой терапии
Феноменологическая - вначале обнаруживался феномен цитотоксичности
субстанции затем исследовались биологические мишени и механизмы реализации биологического
эффекта
Рациональная - на основе фундаментальных молекулярно-биологических и генетических исследований выявляются молекулярные мишени для реализации противоопухолевого эффекта
Слайд 30
Таргетная терапия – лечение, нацеленное на конкретную мишень
в опухолевой клетке, «молекулярно-нацеленная терапия».
Новейшая история противоопухолевой терапии берет
начало с 1990-х годов.
В 1997 году появляется первый препарат, созданный на принципиально новой научной основе – Ритуксимаб, препарат для лечения В-клеточной неходжкинской лимфомы. Это моноклональное антитело разработано для воздействия на заранее установленную молекулярную мишень – трансмембранный антиген СВ20 на поверхности В-лимфоцитов
Слайд 31
Персонализация
Устаревшая модель -недифференцированный подход к терапии
1 ) препарат
неэффективен и токсичен ;
2) препарат эффективен, но токсичен
Новая модель:
выбор пациента для конкретного лекарства повышает эффективность и улучшает переносимость
Слайд 32
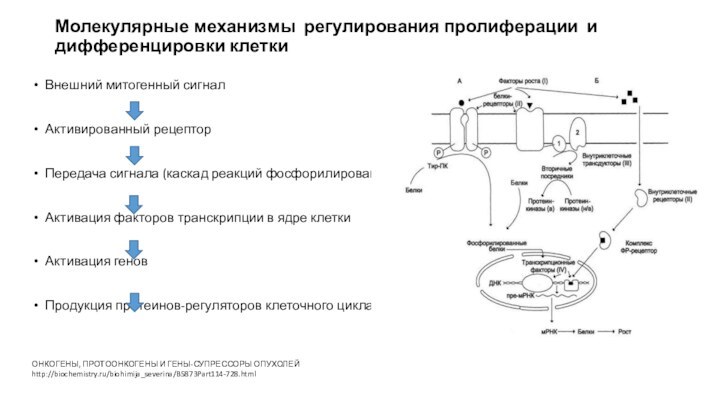
Молекулярные механизмы регулирования пролиферации и дифференцировки клетки
Внешний митогенный
сигнал
Активированный рецептор
Передача сигнала (каскад реакций фосфорилирования)
Активация факторов транскрипции в
ядре клетки
Активация генов
Продукция протеинов-регуляторов клеточного цикла
ОНКОГЕНЫ, ПРОТООНКОГЕНЫ И ГЕНЫ-СУПРЕССОРЫ ОПУХОЛЕЙ http://biochemistry.ru/biohimija_severina/B5873Part114-728.html
Слайд 33
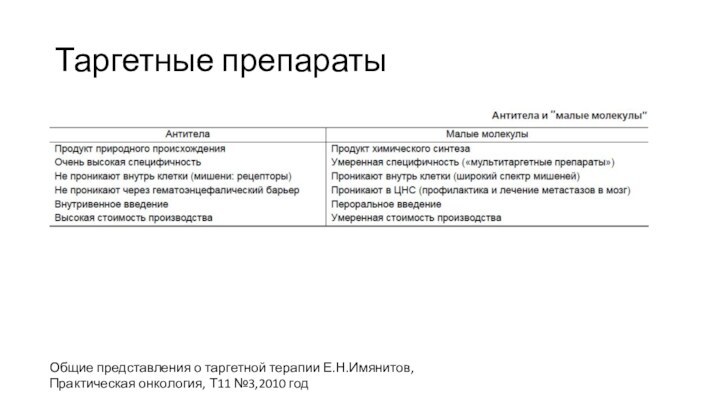
Таргетные препараты
Общие представления о таргетной терапии Е.Н.Имянитов, Практическая
онкология, Т11 №3,2010 год
Слайд 34
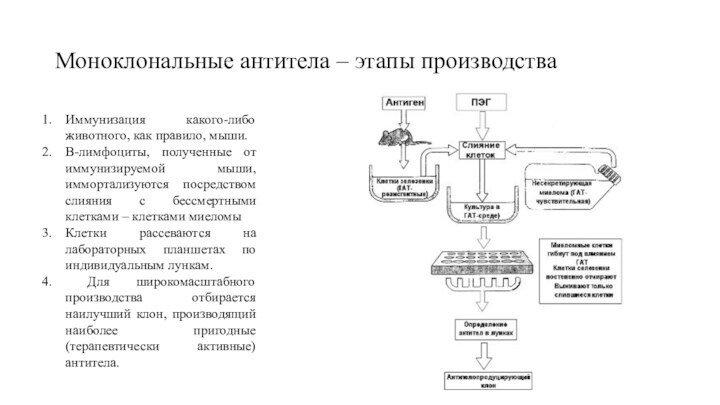
Иммунизация какого-либо животного, как правило, мыши.
B-лимфоциты,
полученные от иммунизируемой мыши, иммортализуются посредством слияния с бессмертными
клетками – клетками миеломы
Клетки рассеваются на лабораторных планшетах по индивидуальным лункам.
Для широкомасштабного производства отбирается наилучший клон, производящий наиболее пригодные (терапевтически активные) антитела.
Моноклональные антитела – этапы производства
Слайд 35
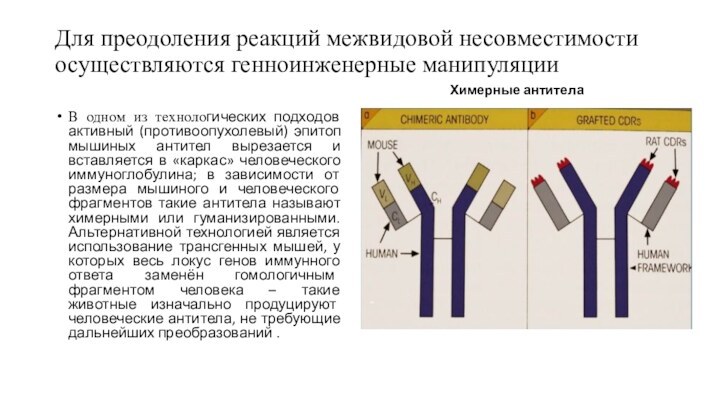
Для преодоления реакций межвидовой несовместимости осуществляются генноинженерные манипуляции
В
одном из технологических подходов активный (противоопухолевый) эпитоп мышиных антител
вырезается и вставляется в «каркас» человеческого иммуноглобулина; в зависимости от размера мышиного и человеческого фрагментов такие антитела называют химерными или гуманизированными. Альтернативной технологией является использование трансгенных мышей, у которых весь локус генов иммунного ответа заменён гомологичным фрагментом человека – такие животные изначально продуцируют человеческие антитела, не требующие дальнейших преобразований .
Химерные антитела
Слайд 36
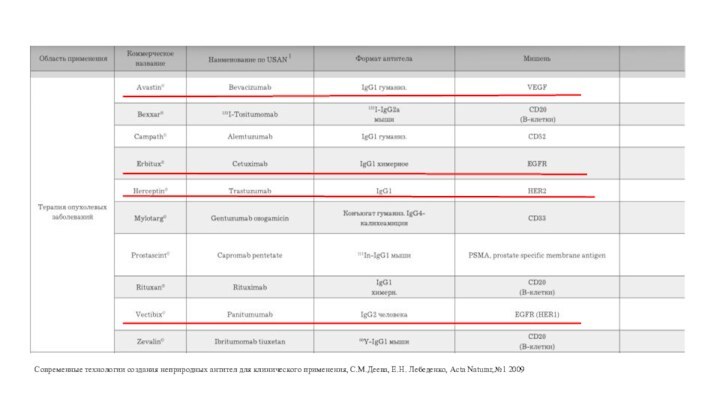
Современные технологии создания неприродных антител для клинического применения,
С.М.Деева, Е.Н. Лебеденко, Acta Naturar,№1 2009
Слайд 37
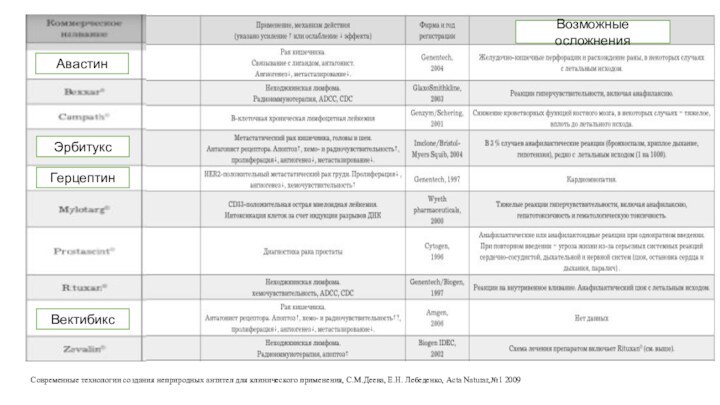
Современные технологии создания неприродных антител для клинического применения,
С.М.Деева, Е.Н. Лебеденко, Acta Naturar,№1 2009
Авастин
Эрбитукс
Герцептин
Вектибикс
Возможные осложнения
Слайд 38
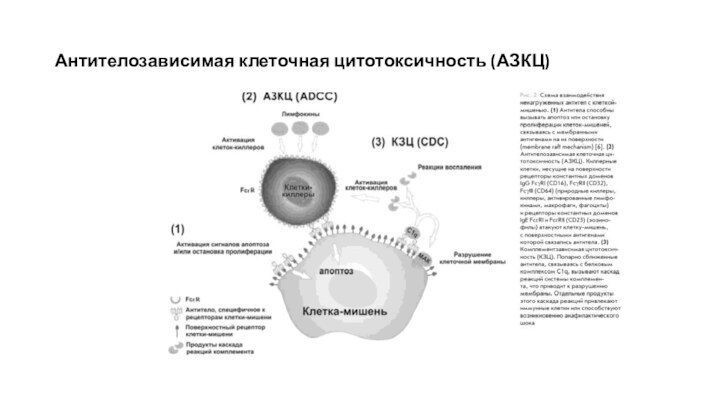
Антителозависимая клеточная цитотоксичность (АЗКЦ)
Слайд 39
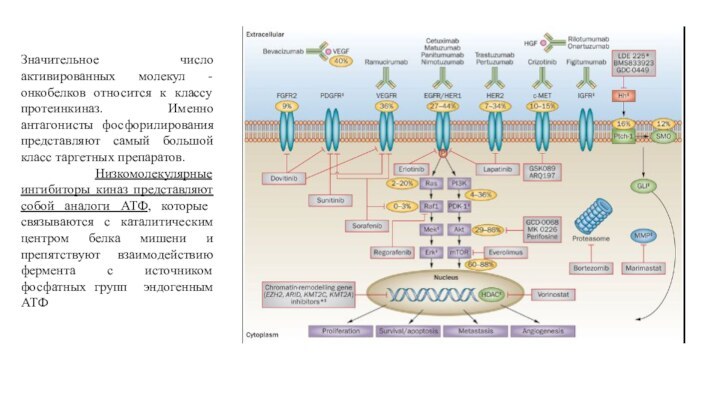
Значительное число активированных молекул - онкобелков относится к
классу протеинкиназ. Именно антагонисты фосфорилирования представляют самый большой класс
таргетных препаратов.
Низкомолекулярные ингибиторы киназ представляют собой аналоги АТФ, которые связываются с каталитическим центром белка мишени и препятствуют взаимодействию фермента с источником фосфатных групп эндогенным АТФ
Слайд 40
Рецепторы эпидермального фактора роста
1) ErbB-1 (HER-1)
2) ErbB-2(HER-2)
3) ErbB-3
(HER-3)
4) ErbB-4 (HER-4)
Экспрессируются на поверхностной мембране нормальных и трансформированных
эпителиальных клеток. Выделено 10 лигандов, взаимодействующих 3 рецепторами ErbB1,ErbB-2,ErbB-4:
эпидермальный фактор роста, бетацеллюлин, гепаринсвязанный эпидермальный фактор роста, трансформирующий фактор роста –альфа, амфирегулин, эпирегулин и нейрорегулины 1-4.
Слайд 41
EGFR (epidermal growth factor receptor)
EGFR (epidermal growth factor
receptor) - трансмембранный рецептор, активирующийся при связывании с эпидермальным
фактором роста – EGF. Сайт связывания рецептора с лигандом находится во внеклеточном домене рецептора, а внутриклеточный домен обладает тирозинкиназной активностью.
При связывании рецептора с лигандом происходит активация EGFR - диммеризация и аутофосфориллирование рецепторов, что индуцирует последовательное фосфориллирование сигнальных внутриклеточных киназ.
При активации EGFR запускаются внутриклеточные сигнальные каскады, приводящие к повышению пролиферации малигнизированных клеток; росту опухоли; стимуляции процессов инвазии, патологического ангиогенеза и метастазирования.
Рецептор EGF (EGFR) является продуктом одного из онкогенов семейства erb - c-erbB1, часто называемом по аналогии с названием кодируемого белка - геном EGFR.
Слайд 42
В ряде опухолей обнаруживаются аномальные рецепторы эпидермального фактора

роста, что обусловлено наличием активирующих мутаций в соответствующем гене.
Такие мутации приводят к стабилизации димерного состояния рецепторов, в результате которой они постоянно находятся в активированном состоянии, независимо от связывания с лигандом . В результате рост опухолевых клеток, несущих мутацию гена EGFR, в большей степени зависит от передачи сигнала по внутриклеточному сигнальному пути, активируемому EGF (эпидермальный фактор роста) , чем рост клеток, не имеющих подобных отклонений.
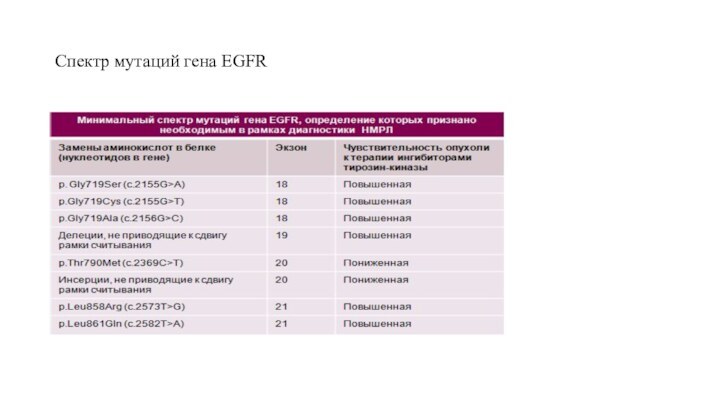
Важно понимать, что под мутациями гена EGFR подразумеваются изменения в самой последовательности ДНК, а не изменения уровня экспрессии белка EGFR и количества копий гена EGFR! Около 90% обнаруженных мутаций представлены делециями в экзоне 19 и точечными заменами в экзоне 21. Существующие литературные данные не только выявляют значимость этих мутаций в регуляции активности рецепторов EGF, но и подтверждают тот факт, что опухоли, несущие подобные мутированные гены хорошо отвечают на воздействие низкомолекулярных ингибиторов тирозинкиназного домена EGFR.
Слайд 43
Методы детекции мутаций гена EGFR
Все методы имеют как
преимущества, так и недостатки, поэтому, выбирая метод для определения,
необходимо ориентироваться на практические аспекты, такие как:
стандартная практика принятая в лаборатории, в которой возможно провести определение
доступность реагентов и оборудования
стоимость тестирования
количество материала
Наиболее широко применяются методы полимеразной цепной реакции в различных вариантах и секвенирование.
Слайд 44
На сегодняшний день с наибольшей чувствительностью и специфичностью
позволяет проводить анализ, применение набора therascreen® EGFR RGQ PCR
(QIAGEN)
одновременное определение 29 мутаций - 19 делеций в экзоне 19, L858R, T790M, L861Q, G719S/A/C, 3 инсерции в экзоне 20, S768I)
высокая чувствительность и специфичность - <1% мутантной ДНК на фоне дикого типа
контрольное измерение тотальной ДНК в образце (амплификация экзона 2 гена EGFR, где отсутствует какой-либо полиморфизм)
Слайд 46
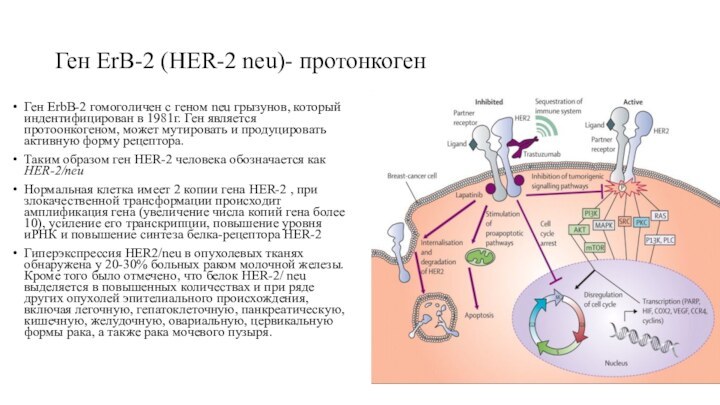
Ген ErB-2 (HER-2 neu)- протонкоген
Ген ErbB-2 гомоголичен
с геном neu грызунов, который индентифицирован в 1981г. Ген
является протоонкогеном, может мутировать и продуцировать активную форму рецептора.
Таким образом ген HER-2 человека обозначается как HER-2/neu
Нормальная клетка имеет 2 копии гена HER-2 , при злокачественной трансформации происходит амплификация гена (увеличение числа копий гена более 10), усиление его транскрипции, повышение уровня иРНК и повышение синтеза белка-рецептора HER-2
Гиперэкспрессия HER2/neu в опухолевых тканях обнаружена у 20-30% больных раком молочной железы. Кроме того было отмечено, что белок HER-2/ neu выделяется в повышенных количествах и при ряде других опухолей эпителиального происхождения, включая легочную, гепатоклеточную, панкреатическую, кишечную, желудочную, овариальную, цервикальную формы рака, а также рака мочевого пузыря.
Слайд 47
Экспресия HER2/neu
Основным методом определения гиперэкспрессии HER2/neu в настоящее

время являются иммуногистохимические исследования, которые проводятся на биопсийном и
операционном материале.
В определенных случаях результаты иммуногистохимической реакции не позволяют уверенно судить об амплификации HER2/neu онкогена, поэтому требуется исследование, прямо выявляющее наличие или отсутствие амплификации. Таким методом является in situ гибридизация: при использовании флуоресцентной метки – FISH (флуоресцентная in situ гибридизация) и при использовании хромогенной метки – CISH (хромогенная in situ гибридизация). При использовании FISH метода требуется дорогостоящее специализированное оборудование и наборы реагентов.
В случае наличия гиперэкспрессии HER2/neu проводится терапия Трастузумабом (герцептином). Это моноклональные антитела, которые находят HER2-рецепторы на поверхности раковой клетки и блокируют их. После этого дальнейший рост опухолевых клеток прекращается, а в ряде случаев наблюдается уменьшение опухоли
Слайд 48
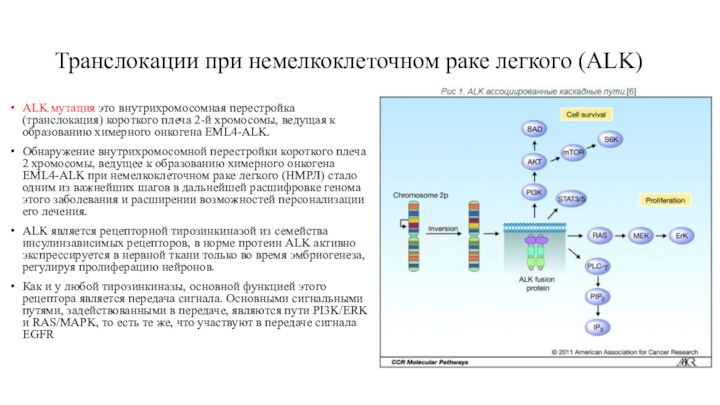
Транслокации при немелкоклеточном раке легкого (ALK)
ALK мутация это
внутрихромосомная перестройка (транслокация) короткого плеча 2-й хромосомы, ведущая к
образованию химерного онкогена EML4-ALK.
Обнаружение внутрихромосомной перестройки короткого плеча 2 хромосомы, ведущее к образованию химерного онкогена EML4-ALK при немелкоклеточном раке легкого (НМРЛ) стало одним из важнейших шагов в дальнейшей расшифровке генома этого заболевания и расширении возможностей персонализации его лечения.
ALK является рецепторной тирозинкиназой из семейства инсулинзависимых рецепторов, в норме протеин ALK активно экспрессируется в нервной ткани только во время эмбриогенеза, регулируя пролиферацию нейронов.
Как и у любой тирозинкиназы, основной функцией этого рецептора является передача сигнала. Основными сигнальными путями, задействованными в передаче, являются пути PI3K/ERK и RAS/MAPK, то есть те же, что участвуют в передаче сигнала EGFR
Слайд 49
Транслокации с участием гена ALK при немелкоклеточном раке
легких
Впервые транслокация с участием гена ALK, а именно: EML4-ALK,
при немелкоклеточном раке легких описана Soda и соавт в 2007 г.
Обнаружение транслокаций при немелкоклеточном раке легких принципиально для проведения терапии таргетным препаратом Кризотинибом. (Ксалкори)
Частота встречаемости транслокаций с участием ALK при немелкоклеточном раке легких по данным разных авторов колеблется от 3 до 13% в зависимости от особенностей выборки
Слайд 50
Метод FISH (гибридизация in situ) в настоящее время
является «золотым стандартом» скрининга для определения транслокаций с участием
гена ALK. Основными преимуществами являются: возможность выявлять все известные виды транслокаций вне зависимости от типа разрыва и гена-партнера, использование материала, прошедшего фиксацию в формалине и заливку парафином.
Слайд 51
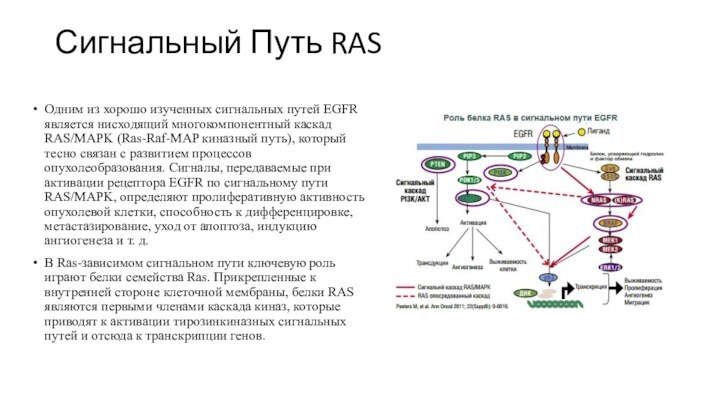
Сигнальный Путь RAS
Одним из хорошо изученных сигнальных путей
EGFR является нисходящий многокомпонентный каскад RAS/MAPK (Ras-Raf-MAP киназный путь),
который тесно связан с развитием процессов опухолеобразования. Сигналы, передаваемые при активации рецептора EGFR по сигнальному пути RAS/MAPK, определяют пролиферативную активность опухолевой клетки, способность к дифференцировке, метастазирование, уход от апоптоза, индукцию ангиогенеза и т. д.
В Ras-зависимом сигнальном пути ключевую роль играют белки семейства Ras. Прикрепленные к внутренней стороне клеточной мембраны, белки RAS являются первыми членами каскада киназ, которые приводят к активации тирозинкиназных сигнальных путей и отсюда к транскрипции генов.
Слайд 52
Нарушение систем передачи сигнала и канцерогенез
Ras - белки
часто упоминают как протоонкогенные продукты: их постоянная активация ведет
к злокачественному перерождению клеток. Характерный механизм перерождения Ras - точечные мутации. Наиболее частыми онкогенными мутациями Ras являются мутации в 12 и 61 кодонах.
При мКРР, несмотря на ингибирование EGFR моноклональными антителами, в опухолевых клетках может происходить активация нисходящего RAS/MAPK сигнального пути, в частности, при мутациях в генах семейства RAS и BRAF. Наиболее часто мутации KRAS определяются в экзоне 2, кодонах 12 и 13. Однако описаны мутации в экзоне 3, кодоне 61, и в экзоне 4, кодонах 117 и 146. При метастатическом колоректальном раке (мКРР) почти 60% пациентов имеют нормальную сигнальную систему EGFR и дикий тип гена KRAS; остальные 40% имеют мутантный тип гена.
Мутации в гене NRAS (в идентичных экзонах и кодонах) при КРР составляют до 5%. Мутации в гене HRAS при аденокарциноме толстой кишки не описаны
Слайд 53
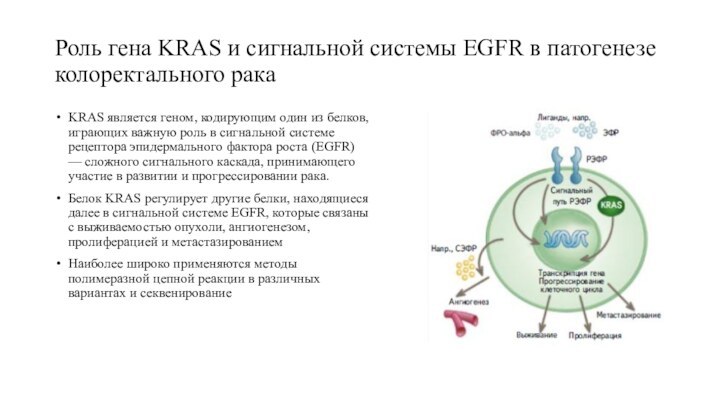
Роль гена KRAS и сигнальной системы EGFR в
патогенезе колоректального рака
KRAS является геном, кодирующим один из белков,
играющих важную роль в сигнальной системе рецептора эпидермального фактора роста (EGFR) — сложного сигнального каскада, принимающего участие в развитии и прогрессировании рака.
Белок KRAS регулирует другие белки, находящиеся далее в сигнальной системе EGFR, которые связаны с выживаемостью опухоли, ангиогенезом, пролиферацией и метастазированием
Наиболее широко применяются методы полимеразной цепной реакции в различных вариантах и секвенирование
Слайд 54
Статус мутации гена KRAS и выбор тактики лечения
больных мКРР
В опухолях с мутированным геном KRAS, белок
KRAS постоянно находится во “включенном” состоянии независимо от наличия активации сигнальной системы EGFR. В результате этого нисходящие эффекты, ведущие к росту опухоли и ее распространению, не регулируются.
У пациентов с мКРР и диким типом гена KRAS при использовании анти-EGFR терапии (Эрбитукс, Вектибикс) в первой линии лечения может наблюдаться частота ответа более 60% и снижение риска прогрессирования на 40%.
Во многих исследованиях было продемонстрировано целесообразность достижения высоких показателей частоты ответа, поскольку последняя коррелирует с большей частотой выполнения резекции и большей вероятностью излечения.
Слайд 55
В рандомизированном контролированном исследовании II фазы OPUS медиана
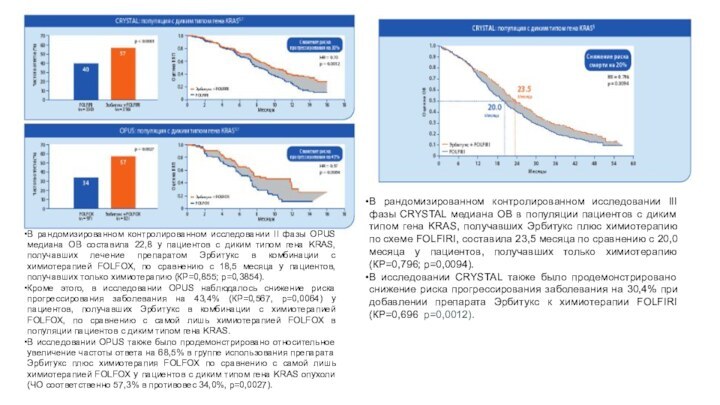
ОВ составила 22,8 у пациентов с диким типом гена
KRAS, получавших лечение препаратом Эрбитукс в комбинации с химиотерапией FOLFOX, по сравнению с 18,5 месяца у пациентов, получавших только химиотерапию (КР=0,855; p=0,3854).
Кроме этого, в исследовании OPUS наблюдалось снижение риска прогрессирования заболевания на 43,4% (КР=0,567, p=0,0064) у пациентов, получавших Эрбитукс в комбинации с химиотерапией FOLFOX, по сравнению с самой лишь химиотерапией FOLFOX в популяции пациентов с диким типом гена KRAS.
В исследовании OPUS также было продемонстрировано относительное увеличение частоты ответа на 68,5% в группе использования препарата Эрбитукс плюс химиотерапия FOLFOX по сравнению с самой лишь химиотерапией FOLFOX у пациентов с диким типом гена KRAS опухоли (ЧО соответственно 57,3% в противовес 34,0%, p=0,0027).
В рандомизированном контролированном исследовании III фазы CRYSTAL медиана ОВ в популяции пациентов с диким типом гена KRAS, получавших Эрбитукс плюс химиотерапию по схеме FOLFIRI, составила 23,5 месяца по сравнению с 20,0 месяца у пациентов, получавших только химиотерапию (КР=0,796; p=0,0094).
В исследовании CRYSTAL также было продемонстрировано снижение риска прогрессирования заболевания на 30,4% при добавлении препарата Эрбитукс к химиотерапии FOLFIRI (КР=0,696; p=0,0012).
Слайд 56
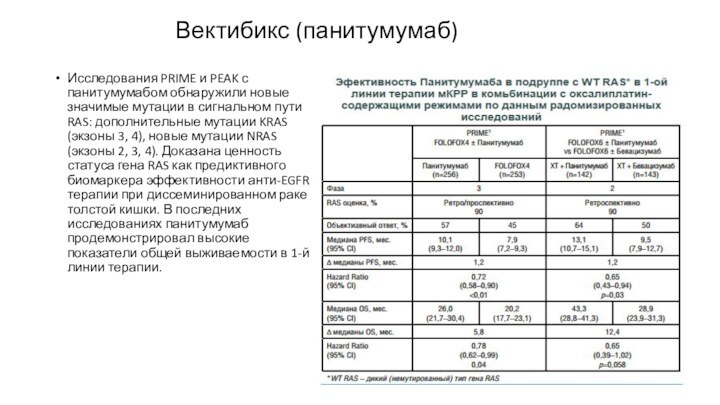
Исследования PRIME и PEAK с панитумумабом обнаружили новые
значимые мутации в сигнальном пути RAS: дополнительные мутации KRAS
(экзоны 3, 4), новые мутации NRAS (экзоны 2, 3, 4). Доказана ценность статуса гена RAS как предиктивного биомаркера эффективности анти-EGFR терапии при диссеминированном раке толстой кишки. В последних исследованиях панитумумаб продемонстрировал высокие показатели общей выживаемости в 1-й линии терапии.
Вектибикс (панитумумаб)
Слайд 57
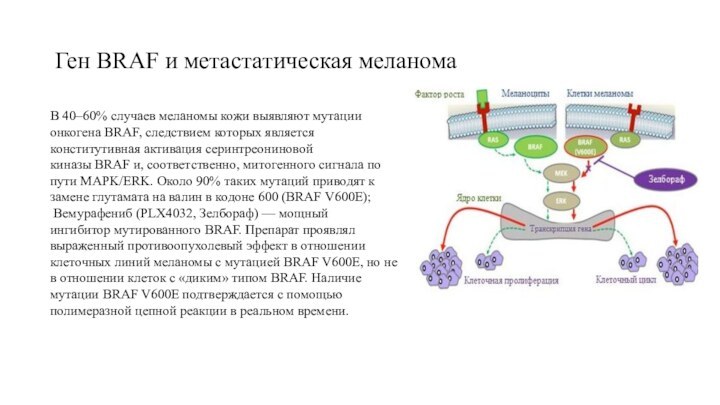
Ген BRAF и метастатическая меланома
В 40–60% случаев меланомы
кожи выявляют мутации онкогена BRAF, следствием которых является конститутивная
активация серинтреониновой
киназы BRAF и, соответственно, митогенного сигнала по пути MAPK/ERK. Около 90% таких мутаций приводят к замене глутамата на валин в кодоне 600 (BRAF V600E);
Вемурафениб (PLX4032, Зелбораф) — мощный
ингибитор мутированного BRAF. Препарат проявлял выраженный противоопухолевый эффект в отношении клеточных линий меланомы с мутацией BRAF V600E, но не в отношении клеток с «диким» типом BRAF. Наличие мутации BRAF V600E подтверждается с помощью полимеразной цепной реакции в реальном времени.
Слайд 58
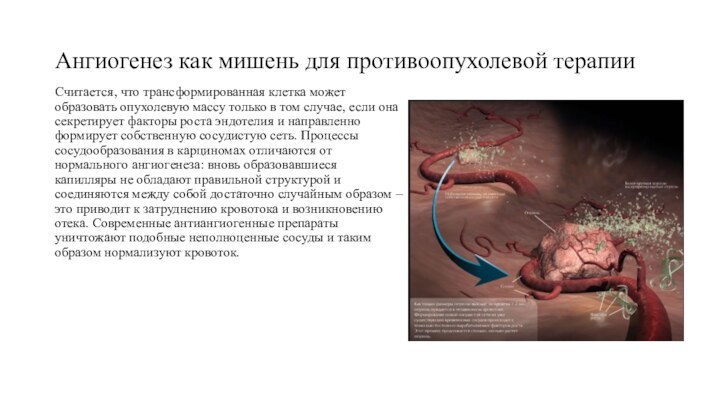
Ангиогенез как мишень для противоопухолевой терапии
Считается, что трансформированная
клетка может образовать опухолевую массу только в том случае,
если она секретирует факторы роста эндотелия и направленно формирует собственную сосудистую сеть. Процессы сосудообразования в карциномах отличаются от нормального ангиогенеза: вновь образовавшиеся капилляры не обладают правильной структурой и соединяются между собой достаточно случайным образом – это приводит к затруднению кровотока и возникновению отека. Современные антиангиогенные препараты уничтожают подобные неполноценные сосуды и таким образом нормализуют кровоток.
Слайд 59
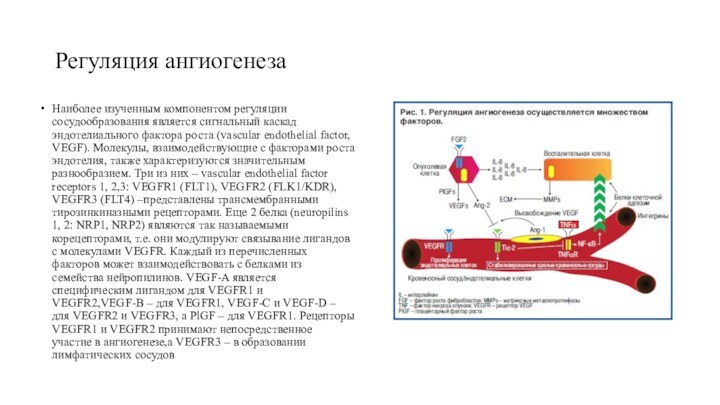
Регуляция ангиогенеза
Наиболее изученным компонентом регуляции сосудообразования является сигнальный
каскад эндотелиального фактора роста (vascular endothelial factor, VEGF). Молекулы,
взаимодействующие с факторами роста эндотелия, также характеризуются значительным разнообразием. Три из них – vascular endothelial factor receptors 1, 2,3: VEGFR1 (FLT1), VEGFR2 (FLK1/KDR), VEGFR3 (FLT4) –представлены трансмембранными тирозинкиназными рецепторами. Еще 2 белка (neuropilins 1, 2: NRP1, NRP2) являются так называемыми корецепторами, т.е. они модулируют связывание лигандов с молекулами VEGFR. Каждый из перечисленных факторов может взаимодействовать с белками из семейства нейропилинов. VEGF-A является специфическим лигандом для VEGFR1 и VEGFR2,VEGF-B – для VEGFR1, VEGF-С и VEGF-D – для VEGFR2 и VEGFR3, а PlGF – для VEGFR1. Рецепторы VEGFR1 и VEGFR2 принимают непосредственное участие в ангиогенезе,а VEGFR3 – в образовании лимфатических сосудов
Слайд 60
Назначение ингибиторов ангиогенеза может оказать положительное влияние на

состояние опухолевого кровотока. Уничтожение опухольиндуцированных сосудов, которые в отличие
от нормальных капилляров не отличаются налаженным взаимодействием эндотелиальных и стромальных клеток, возвращает систему кровотока к правильной архитектуре – этот феномен в специальной литературе принято обозначать термином «нормализация». В результате разрешается отек, восстанавливается оксигенация трансформированных клеток, нормализуется рН. Все это улучшает условия для доставки цитостатических препаратов непосредственно в опухоль, при этом трансформированные клетки-мишени начинают делиться и, следовательно, становятся чувствительными к воздействию ДНК-повреждающих агентов.
Таким образом, главный парадокс существующих терапевтических подходов к применению ингибиторов ангиогенеза – полное несоответствие между первоначальной концепцией и полученным результатом. Энтузиасты антиангиогенной терапии задумывали это направление как способ лишить опухоль кровотока и именно таким образом уничтожить опухолевые клетки.
Тем не менее, существующая практика применения антиангиогенных препаратов эксплуатирует совершенно противоположный механизм: по сути уничтожаются не все, а лишь незрелые сосуды опухоли. Это приводит не к угнетению, а к улучшению внутриопухолевого кровотока. В результате опухолевые клетки не прекращают, а, наоборот, начинают делиться, однако именно пролиферация делает их уязвимыми к химиотерапевтическим воздействиям. Именно поэтому терапевтическое применение ингибиторов ангиогенеза для большинства разновидностей опухолей имеет биологические предпосылки только в случае использования комбинаций с цитостатическими препаратами.
Особую группу неоплазм составляют карциномы почки и глиобластомы. Эти разновидности новообразований характеризуются не физиологической (адаптивной), а патологической активацией процессов ангиогенеза. Именно это объясняет успех антиангиогенной монотерапии для лечения упомянутых заболеваний
Концепция нормализации внутриопухолевого кровотока под
воздействием антиангиогенной терапии
Слайд 61
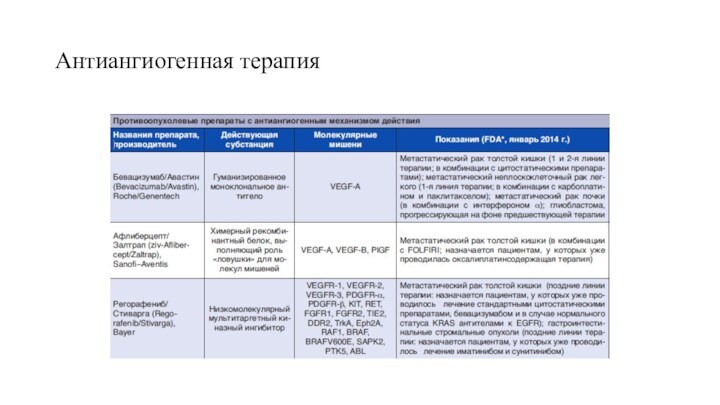
Антиангиогенные лекарственные препараты
Ангиогенез как мишень
для противоопухолевой терапииЕ.Н.Имянитов СОВРЕМЕННАЯ
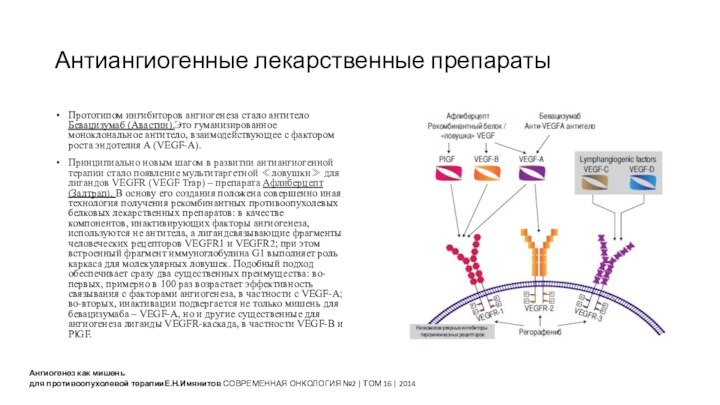
ОНКОЛОГИЯ №2 | ТОМ 16 | 2014
Прототипом ингибиторов
ангиогенеза стало антитело Бевацизумаб (Авастин).Это гуманизированное моноклональное антитело, взаимодействующее с фактором роста эндотелия A (VEGF-A).
Принципиально новым шагом в развитии антиангиогенной терапии стало появление мультитаргетной ≪ловушки≫ для лигандов VEGFR (VEGF Trap) – препарата Афлиберцепт (Залтрап). В основу его создания положена совершенно иная технология получения рекомбинантных противоопухолевых белковых лекарственных препаратов: в качестве компонентов, инактивирующих факторы ангиогенеза, используются не антитела, а лигандсвязывающие фрагменты человеческих рецепторов VEGFR1 и VEGFR2; при этом встроенный фрагмент иммуноглобулина G1 выполняет роль каркаса для молекулярных ловушек. Подобный подход обеспечивает сразу два существенных преимущества: во-первых, примерно в 100 раз возрастает эффективность связывания с факторами ангиогенеза, в частности с VEGF-A; во-вторых, инактивации подвергается не только мишень для бевацизумаба – VEGF-A, но и другие существенные для ангиогенеза лиганды VEGFR-каскада, в частности VEGF-B и PlGF.
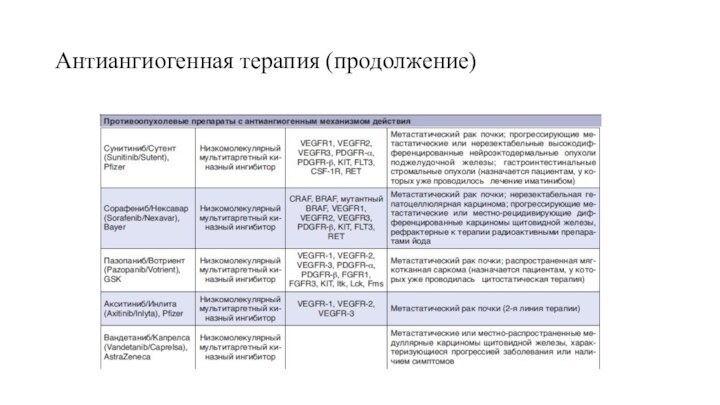
Слайд 63
Антиангиогенная терапия (продолжение)