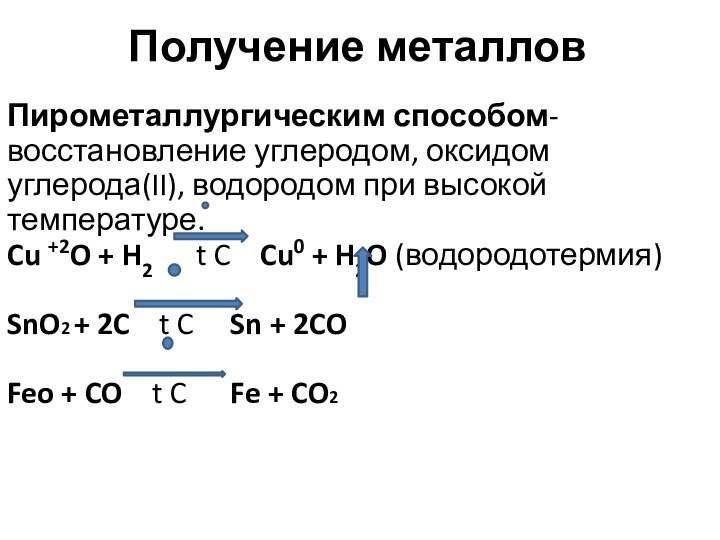
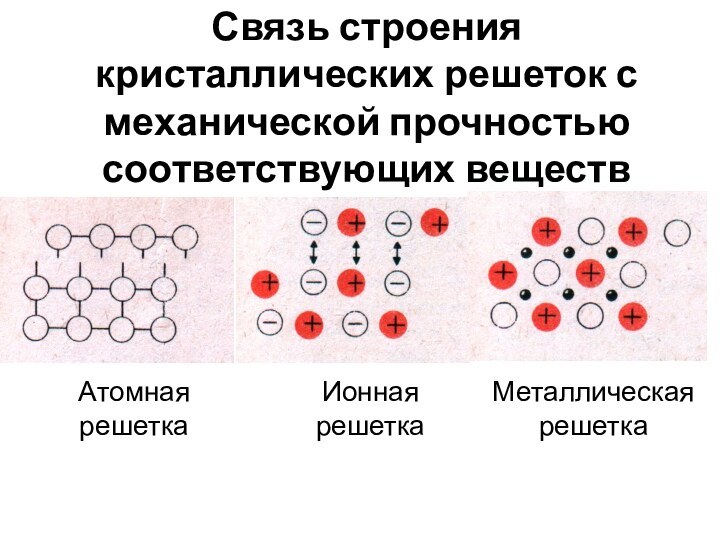
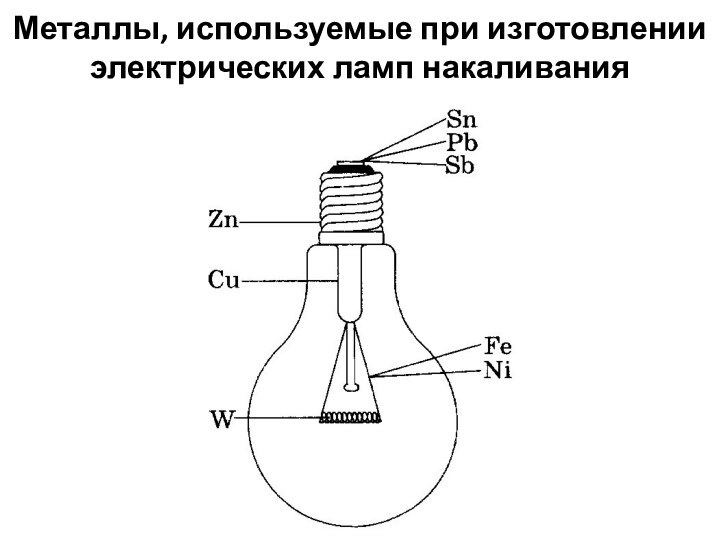
лат. metallum – шахта, рудник):
группа элементов, обладающая харак-
терными металлическими
свойствами,такими как высокие электро- и тепло-
проводность, положительный тем-
пературный коэффициент сопротив-
ления, высокая пластичность и метал-
лический блеск.