- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Содержание
- 2. кислоты - вещества, способные в растворах отдавать протоноснования - вещества, способные присоединять протон теория Бренстеда-Лоурипротолитическая теориякислотасопряженнаякислотаоснованиесопряженноеоснование
- 3. Классификация органических кислот ОН-кислоты: спирты, фенолы, карбоновые
- 4. алкилоксониевый ион алкиламмониевый ионПоложительно заряженные ионы:Классификация органических кислот
- 5. pKa — количественная характеристика кислотных свойств; pKa = -lg Ka
- 6. Качественная характеристика кислотности – стабильность аниона, образующегося при диссоциации кислоты чем стабильнее анион, тем сильнее кислота
- 7. Стабильность аниона зависит:от природы атома: электроотрицательности и
- 8. Электроотрицательность элементов кислотного центраучитывается, если кислоты имеют
- 9. Радиус атома учитывается, если кислоты имеют одинаковые
- 10. Если радикалы кислот одинаковыR-SH > R-OH > R-NH2 > R-CH3
- 11. Реакции замещениятиолы используют как антидоты при отравлении соединениями мышьяка, ртути, хрома, висмута
- 13. 2,3-димеркапто- пропанол-1 БАЛ+нетоксичное производноелюизит
- 14. Степень делокализации отрицательного заряда в анионе учитывается,
- 15. Сравнение кислотности этанола и фенола12
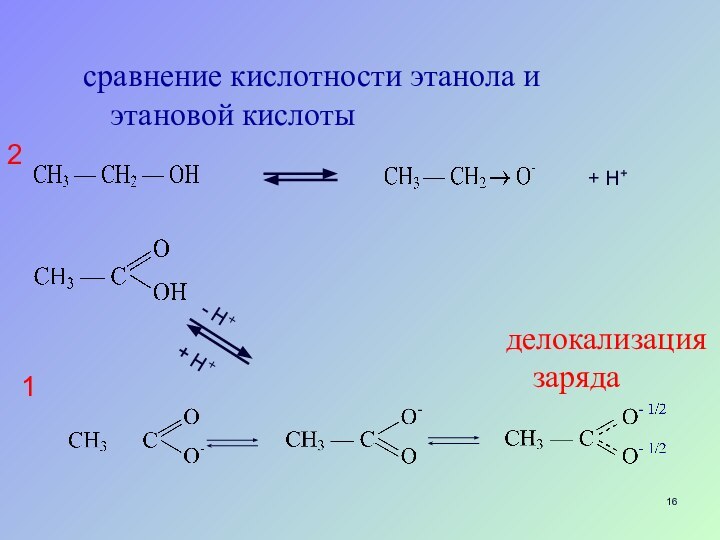
- 16. сравнение кислотности этанола и этановой кислоты+ H+делокализация заряда12
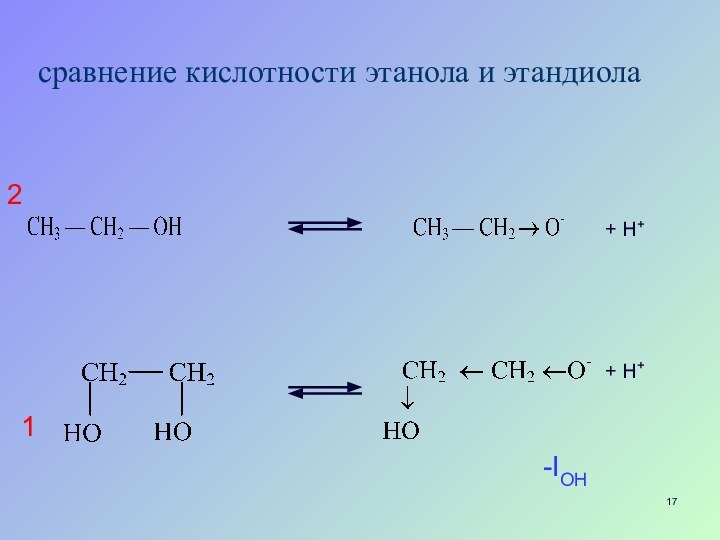
- 17. сравнение кислотности этанола и этандиола+ H++ H+12-IOH
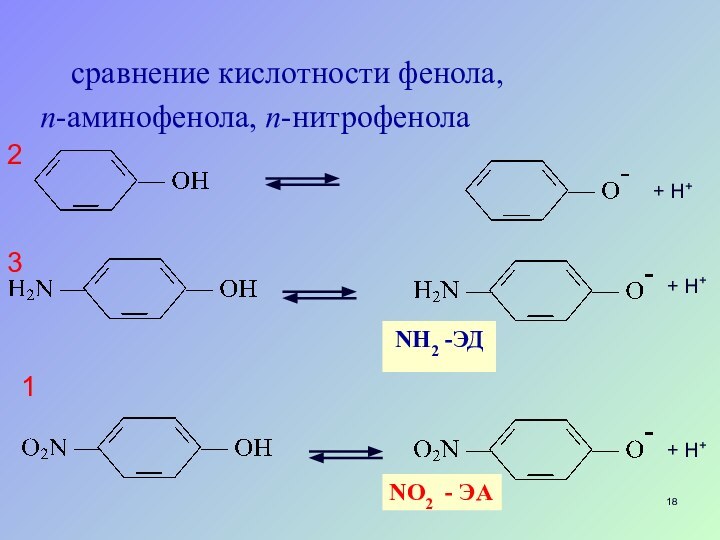
- 18. сравнение кислотности фенола, п-аминофенола, п-нитрофенолаNH2 -ЭДNО2 - ЭА132+ H++ H++ H+
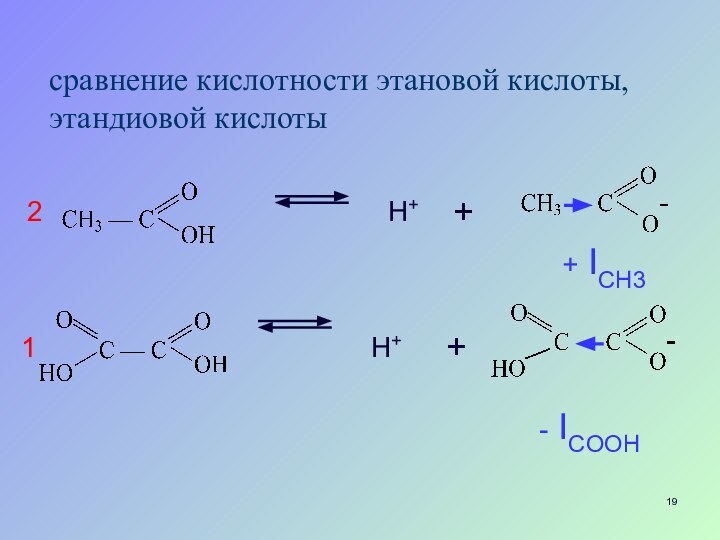
- 19. сравнение кислотности этановой кислоты, этандиовой кислоты H+ H+ + + - ICOOH + ICH312
- 20. сравнение кислотности п-гидроксибензойной кислоты и о- п-гидроксибензойной кислоты рКа 4,58 рКа 2,98
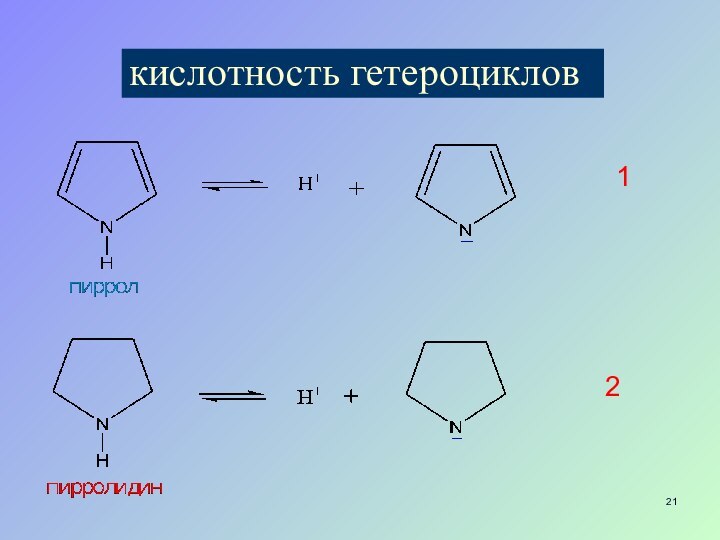
- 21. кислотность гетероциклов12
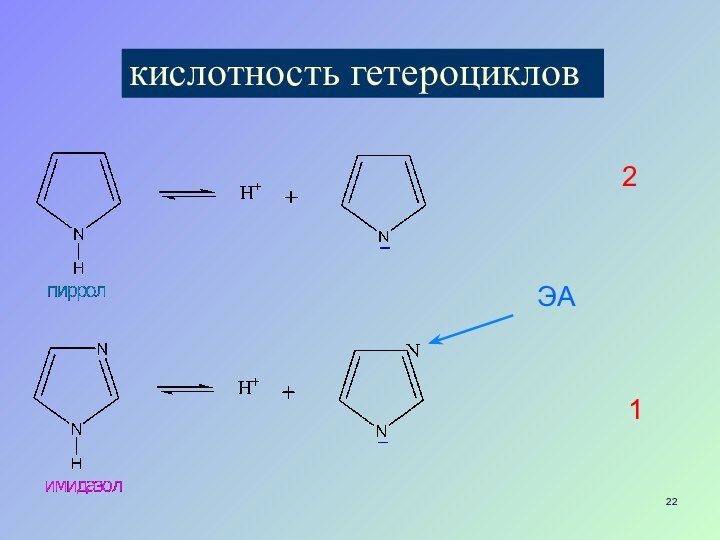
- 22. кислотность гетероциклов12ЭА
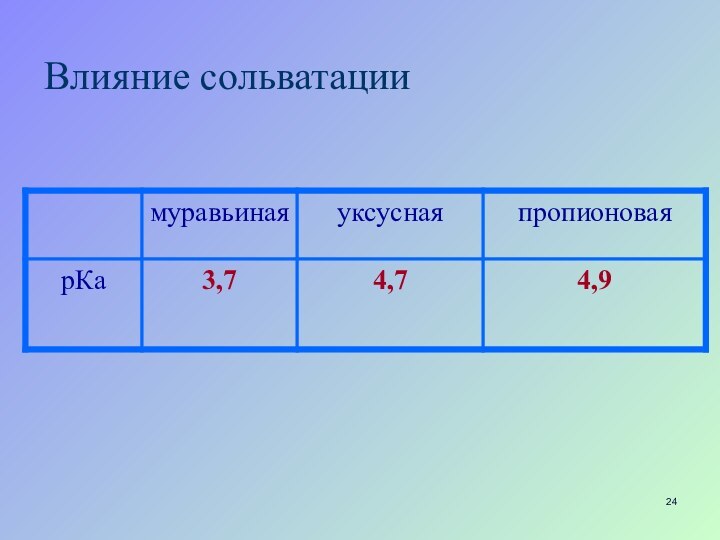
- 23. Влияние сольватации чем меньше размер иона, чем больше локализован заряд, тем лучше ион сольватируется
- 24. Влияние сольватации
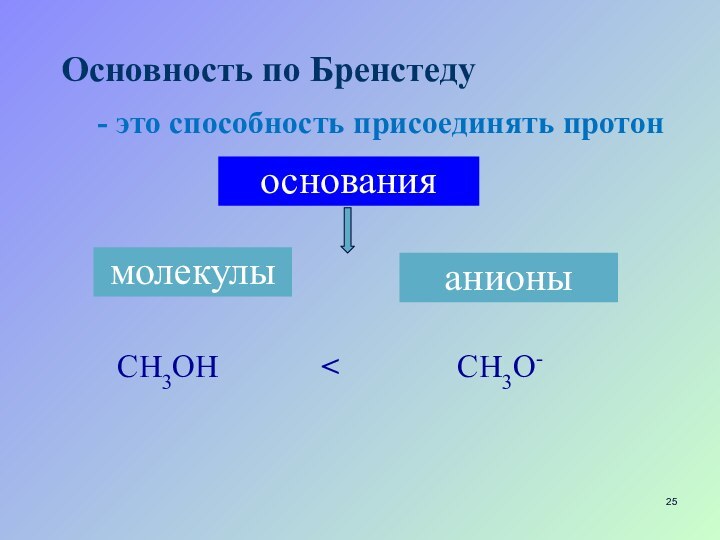
- 25. Основность по БренстедуCH3OHмолекулы- это способность присоединять протоноснованияанионыCH3O-
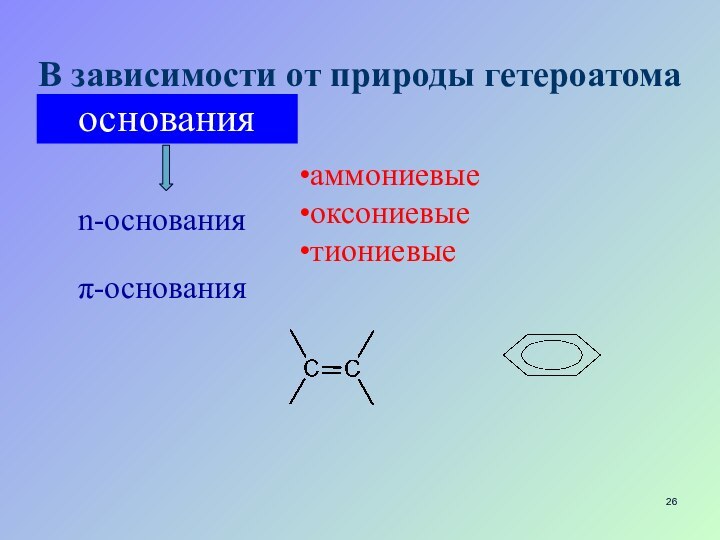
- 26. В зависимости от природы гетероатомаn-основанияπ-основанияаммониевыеоксониевыетиониевыеоснования
- 27. чем выше рКвн+, тем сильнее основаниерКвн+ = -lg Квн+рКвн+ - количественная характеристика основности
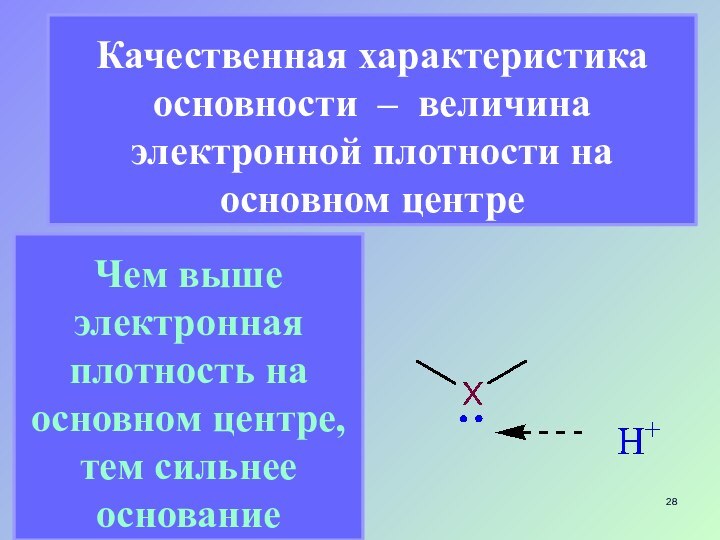
- 28. Качественная характеристика основности – величина электронной плотности
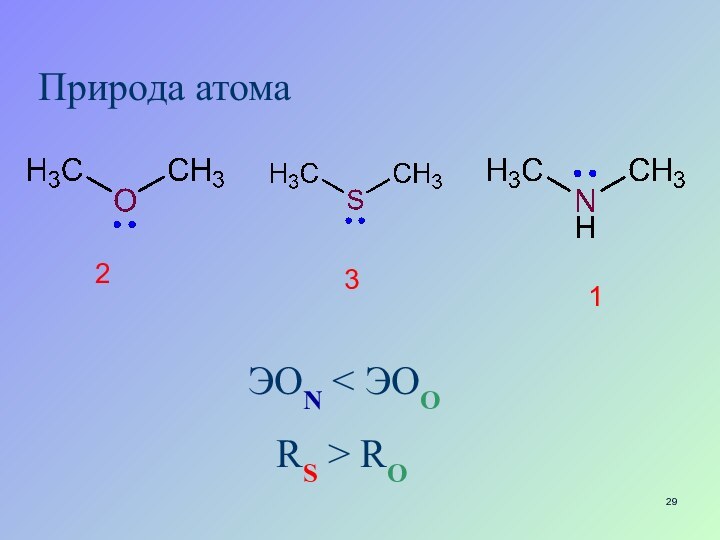
- 29. Природа атома12ЭON < ЭOО3RS > RО
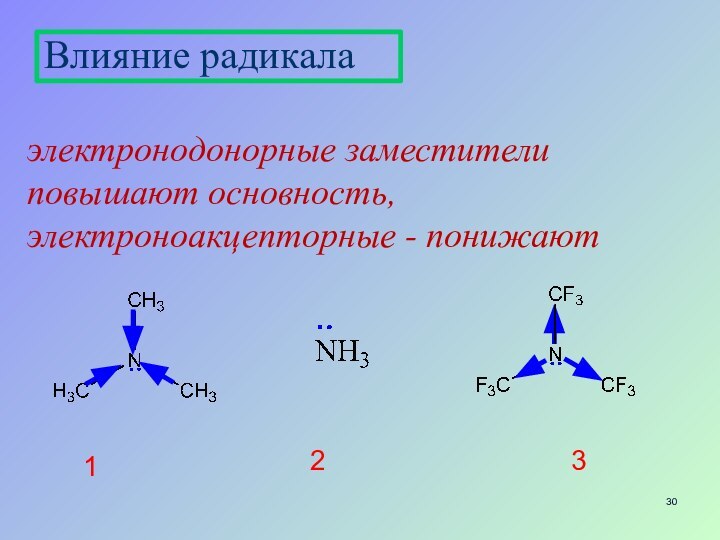
- 30. Влияние радикала
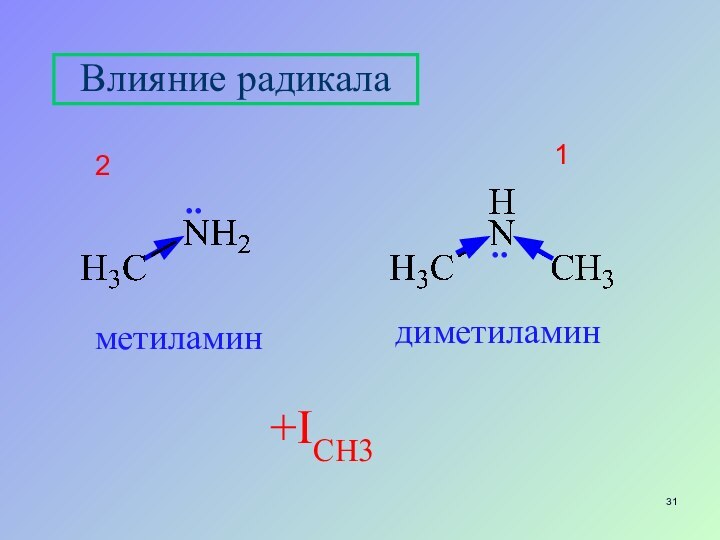
- 31. Влияние радикала +IСН3метиламиндиметиламин12....
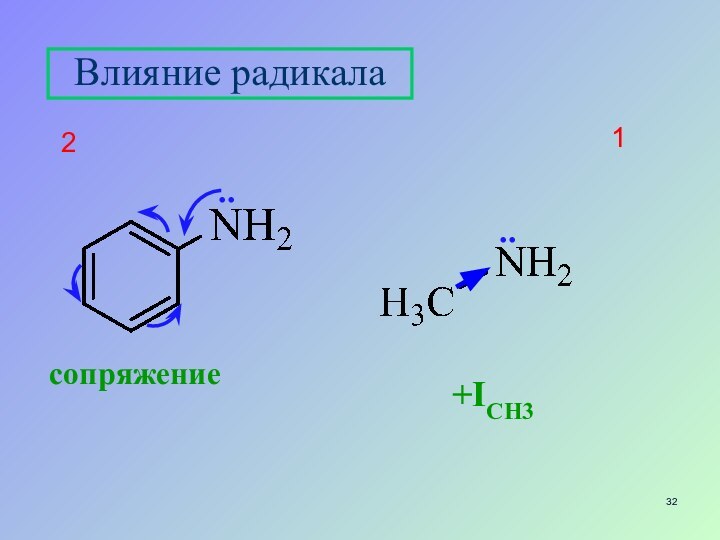
- 32. сопряжение+IСН312Влияние радикала ....
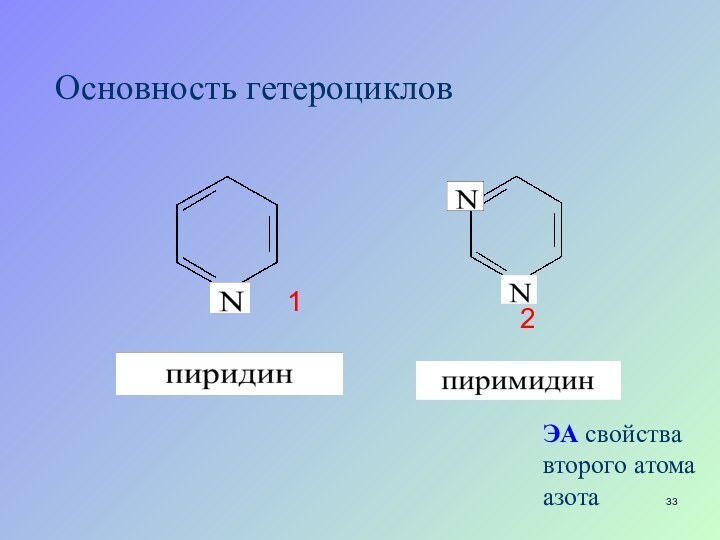
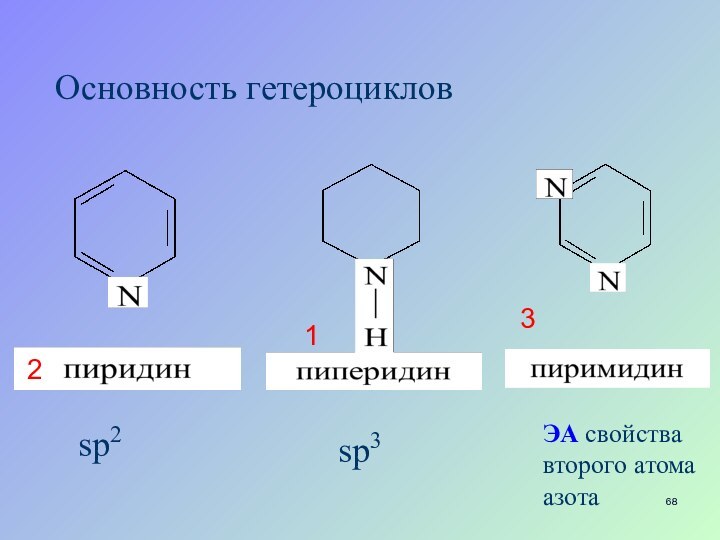
- 33. Основность гетероцикловЭА свойства второго атома азота12
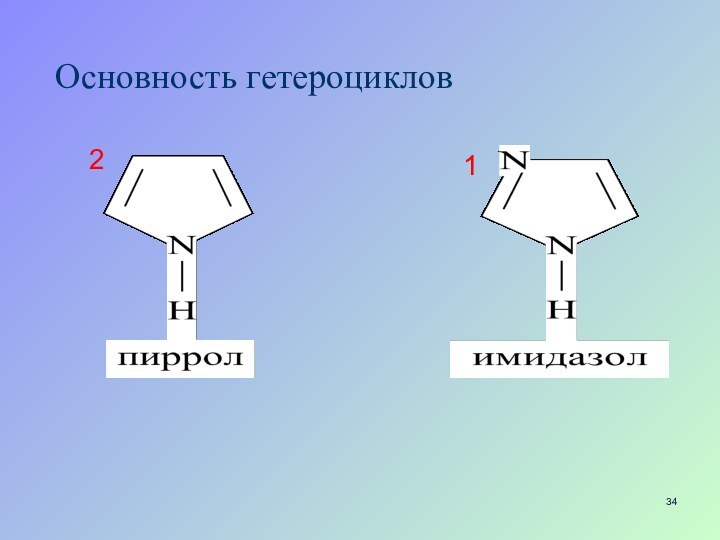
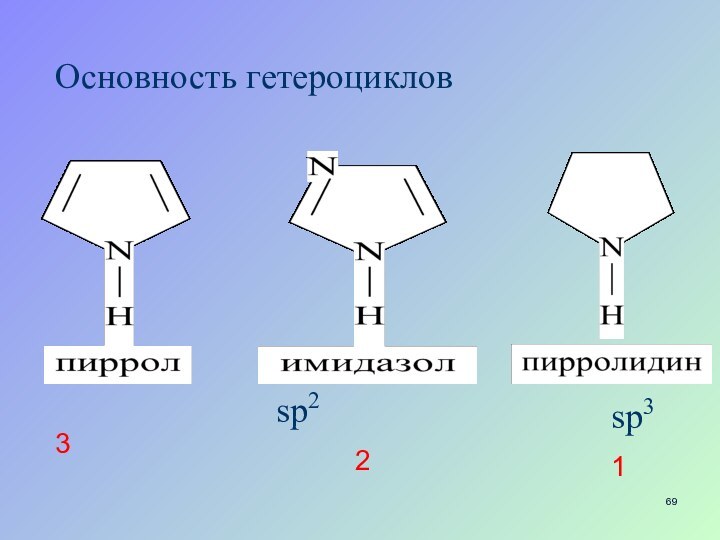
- 34. Основность гетероциклов12
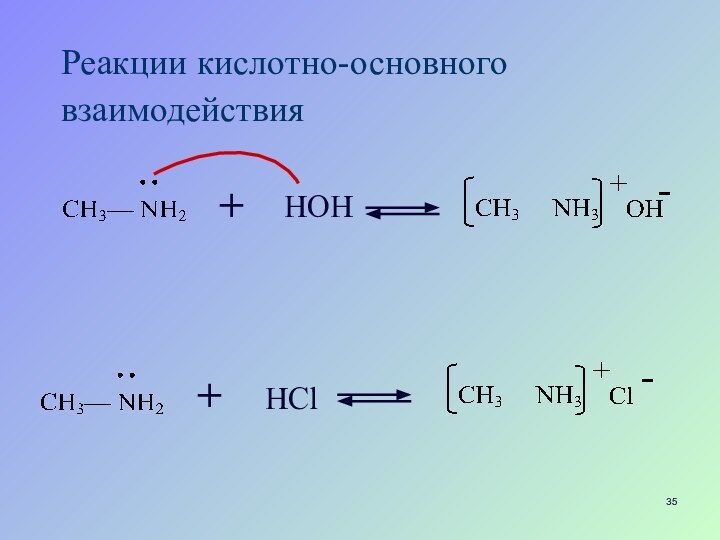
- 35. +НОННСl+Реакции кислотно-основного взаимодействия
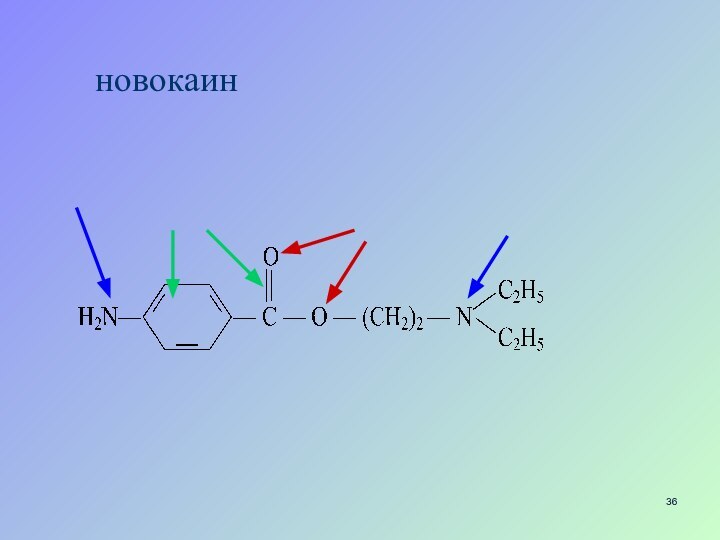
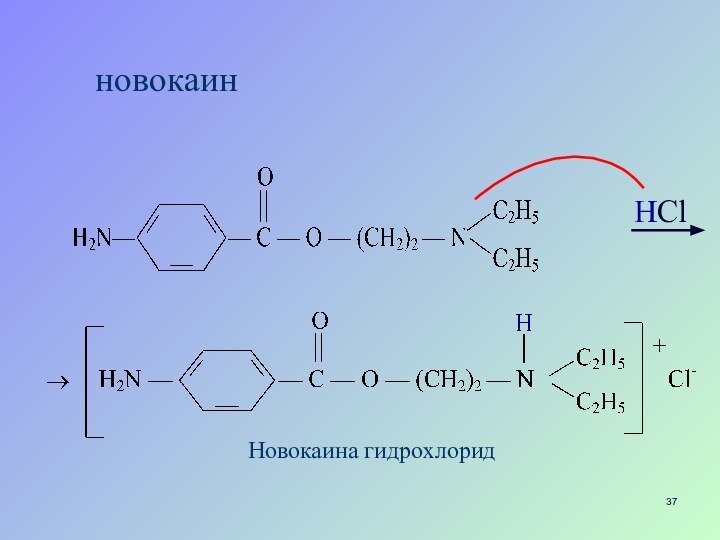
- 36. новокаин
- 37. новокаин НСlНовокаина гидрохлорид
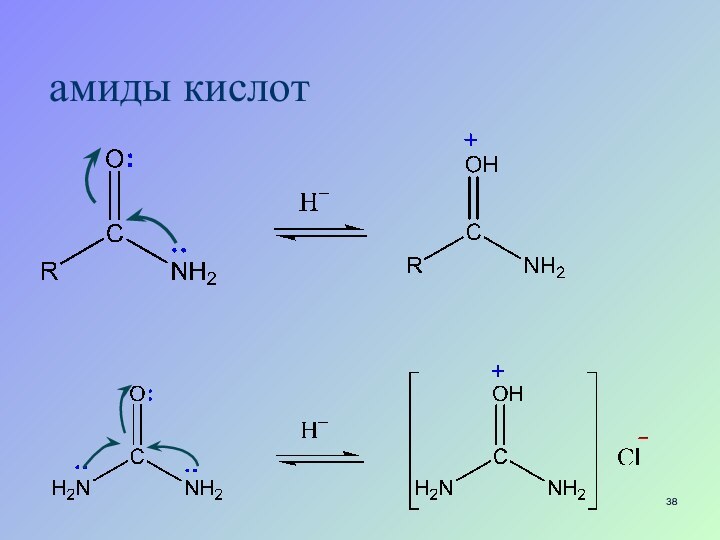
- 38. амиды кислот
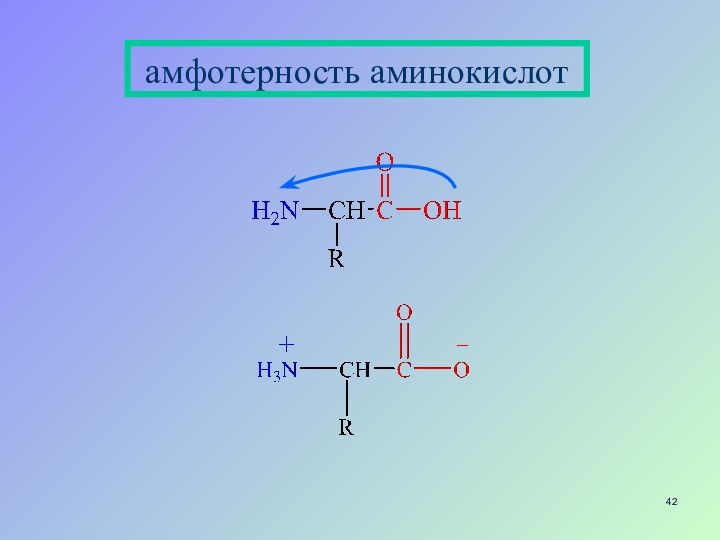
- 39. Амфотерность органических соединенийспирты гидроксикислоты фенолокислоты аминокислоты пуриновые и пиримидиновые основания
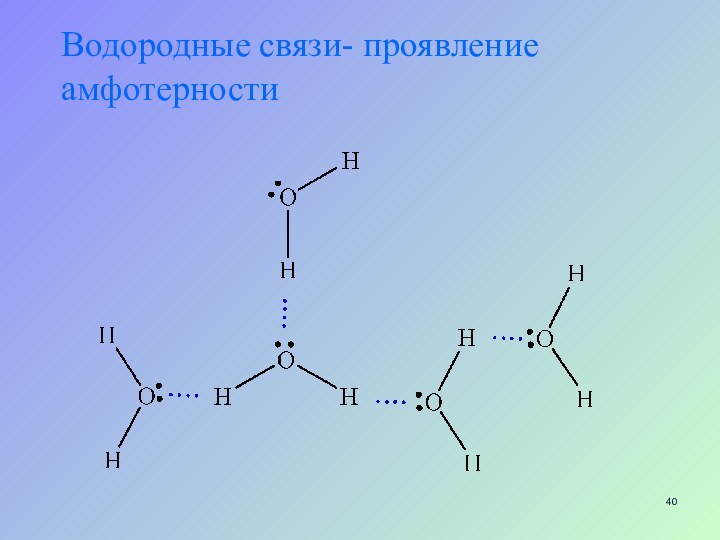
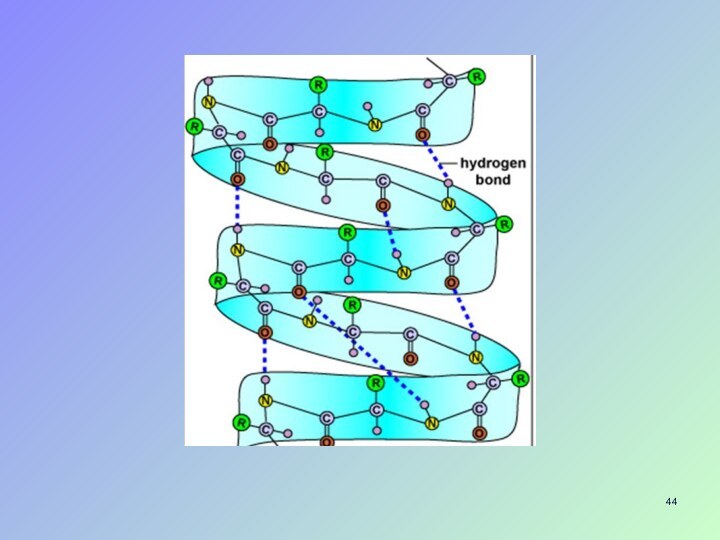
- 40. Водородные связи- проявление амфотерности
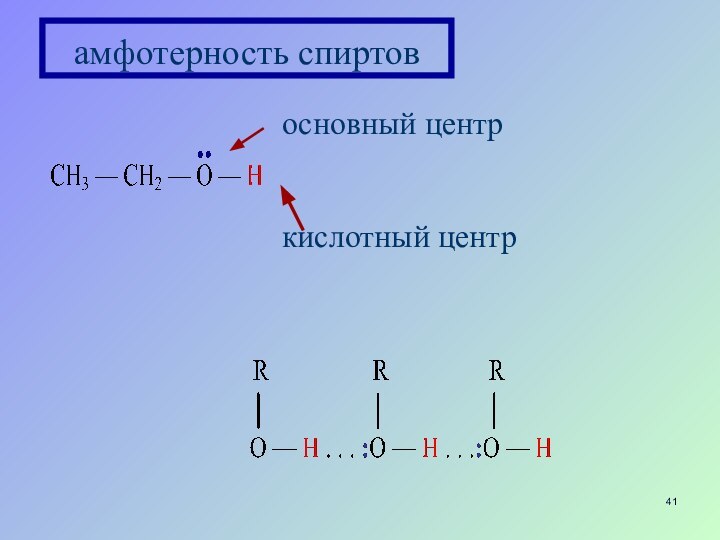
- 41. основный центркислотный центрамфотерность спиртов
- 42. амфотерность аминокислот
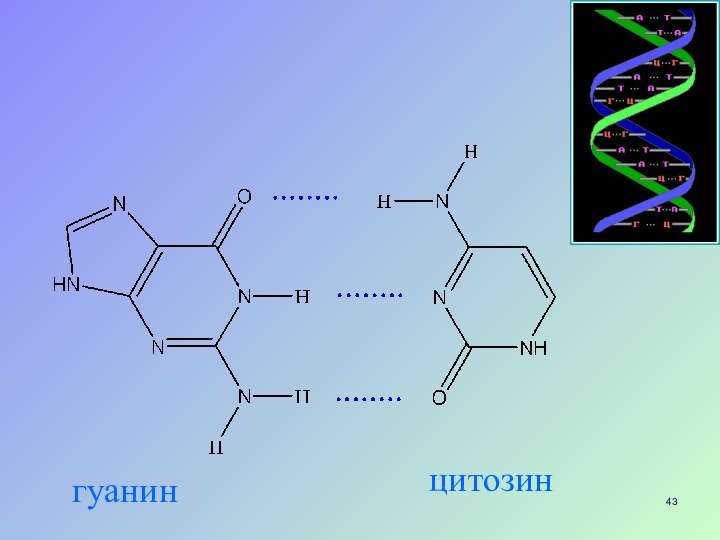
- 43. гуанинцитозин
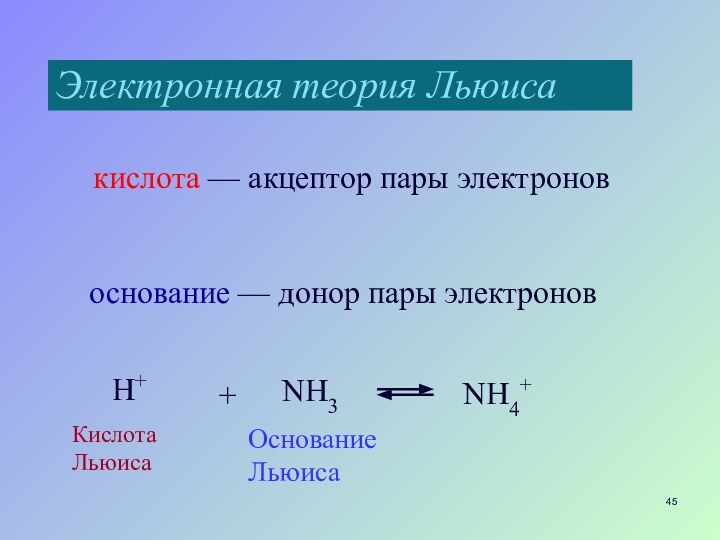
- 45. Электронная теория Льюиса кислота — акцептор пары электроновоснование — донор пары электронов
- 46. Кислотыжесткиемягкие малый R
- 47. Основанияжесткиемягкие трудно окисляются
- 48. ПЖМКО –принцип жестких и мягких кислот и
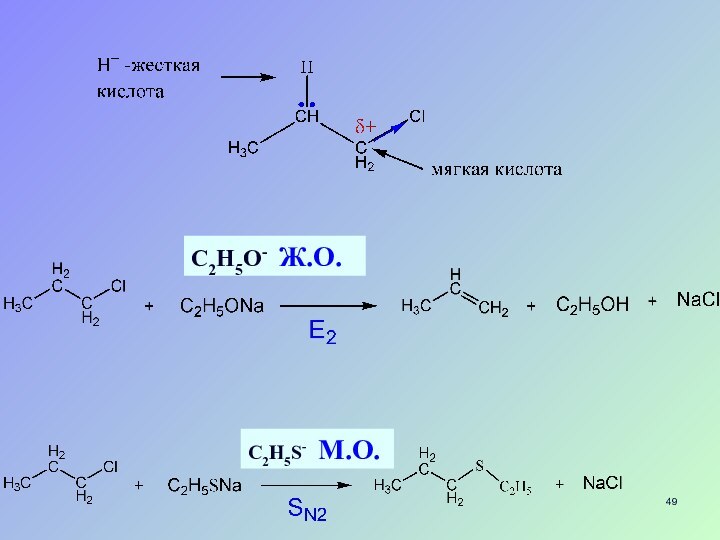
- 49. С2Н5О- Ж.О.С2Н5S- M.О.
- 50. Кислотность, основность в биологических системахБольшинство БВС и
- 51. ацетилсалициловая кислота рКа 3,5При рН = 3,5
- 53. Классификация органических реакций
- 54. В органической химии субстрат – это соединение,
- 55. Для того чтобы осуществилась реакция, необходимо столкновение
- 57. По направлению реакций с учетом конечного
- 58. р. окислительно-восстановительные р. кислотно-основного взаимодействия
- 59. мономолекулярныебимолекулярные По числу молекул, участвующих в стадии, определяющей скорость реакции:
- 60. По характеру изменений связей в субстрате и реагентерадикальные ионные согласованные
- 61. Радикальные реакции Гомолитический разрыв связи свободные радикалы: sp2-гибридизацияплоскостное строение
- 62. Признаки радикальных реакций1.гомолитически разрывается неполярная ков. связь
- 63. 4. чувствительны к действию акцепторов электронов
- 64. Ионные реакции Гетеролитический разрыв связи
- 65. Реагенты:Нуклеофильные реагенты NuОбразуют новые ковалентные
- 66. Реагенты:Электрофильные ЕОбразуют новые ковалентные
- 67. Признаки ионных реакций1. гетеролитически разрывается полярная ков.
- 68. Основность гетероцикловsp3sp2ЭА свойства второго атома азота123
- 69. Основность гетероцикловsp3sp2123
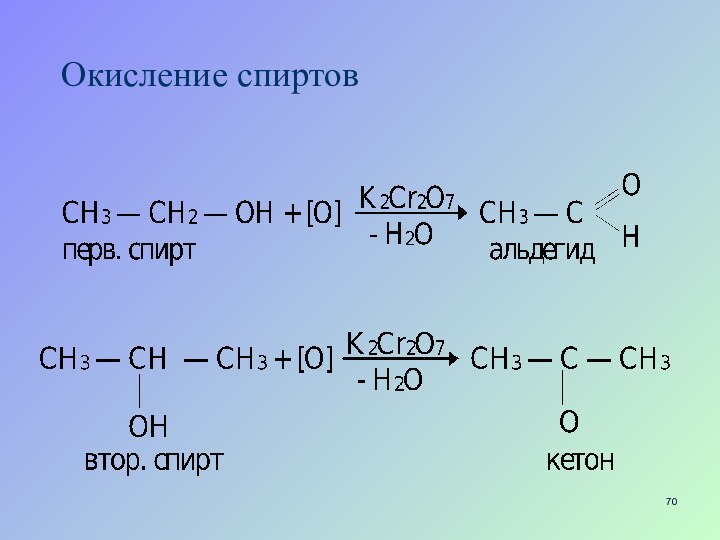
- 70. Окисление спиртов
- 71. тиолы в мягких условиях окисляются до дисульфидовтиолы окисляются легко[O]диалкилдисульфидАнтиоксиданты – вещества, препятствующие окислению
- 73. Степень ионизации зависит от рН раствора и
- 74. Скачать презентацию
- 75. Похожие презентации



























![КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ тиолы в мягких условиях окисляются до дисульфидовтиолы окисляются легко[O]диалкилдисульфидАнтиоксиданты – вещества, препятствующие окислению](/img/tmb/14/1359442/82ff7834f8e60b1dff54a9e65a083e90-720x.jpg)


Слайд 2
кислоты - вещества, способные в растворах отдавать протон
основания
- вещества, способные присоединять протон
Слайд 3
Классификация органических кислот
ОН-кислоты: спирты, фенолы, карбоновые кислоты,
сульфокислоты, гидроксикислоты, аминокислоты
SH-кислоты: тиоспирты, SH-содержащие соединения
NH-кислоты: амины,
имины, гетероциклические соединения с атомом азотаСН-кислоты: углеводороды, радикалы гетерофункциональных соединений
Кислотность
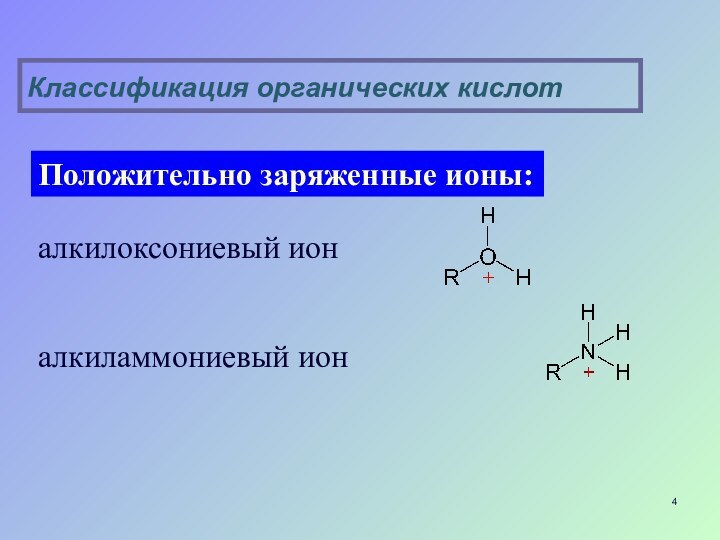
Слайд 4
алкилоксониевый ион
алкиламмониевый ион
Положительно заряженные ионы:
Классификация органических кислот
Слайд 6 Качественная характеристика кислотности – стабильность аниона, образующегося при
диссоциации кислоты
чем стабильнее анион, тем сильнее кислота
Слайд 7
Стабильность аниона зависит:
от природы атома: электроотрицательности и поляризуемости
(радиуса)
от степени делокализации отрицательного заряда в анионе
от способности
к сольватации
Слайд 8
Электроотрицательность элементов кислотного центра
учитывается, если кислоты имеют одинаковые
радикалы и элементы кислотного центра расположены в одном периоде
1
2
R-OH
> R-NH2 > R-CH3
Слайд 9
Радиус атома
учитывается, если кислоты имеют одинаковые радикалы
и элементы кислотного центра расположены в одной группе
Rs >
Ro 1
2
Слайд 11
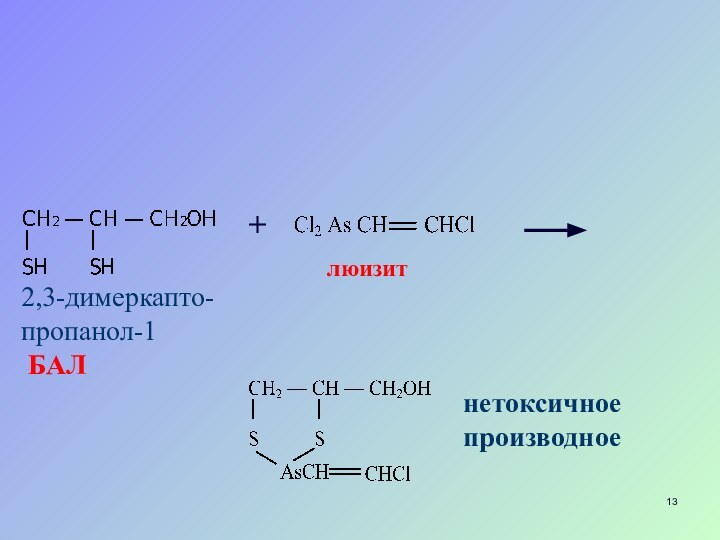
Реакции замещения
тиолы используют как антидоты при отравлении соединениями
мышьяка, ртути, хрома, висмута
Слайд 14
Степень делокализации отрицательного заряда в анионе
учитывается, если
кислоты имеют одинаковые кислотные центры
наличие сопряжения, электроноакцепторных заместителей увеличивает
стабильность анионаналичие электронодонорных заместителей уменьшает стабильность аниона
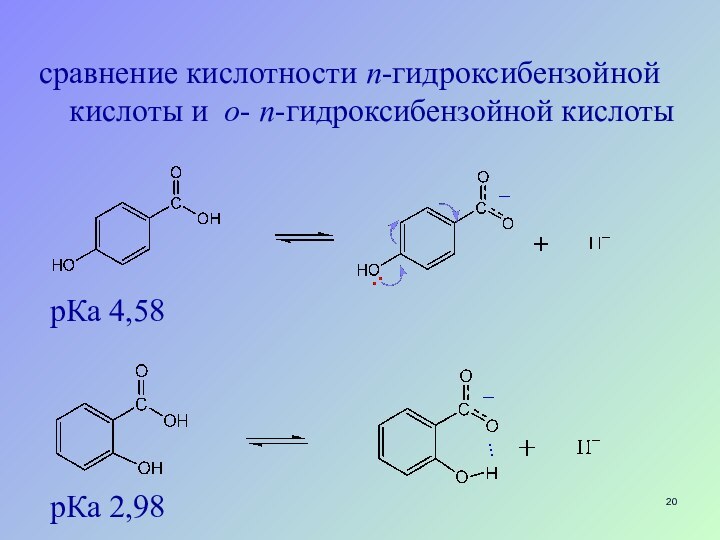
Слайд 20 сравнение кислотности п-гидроксибензойной кислоты и о- п-гидроксибензойной
кислоты
рКа 4,58
рКа 2,98
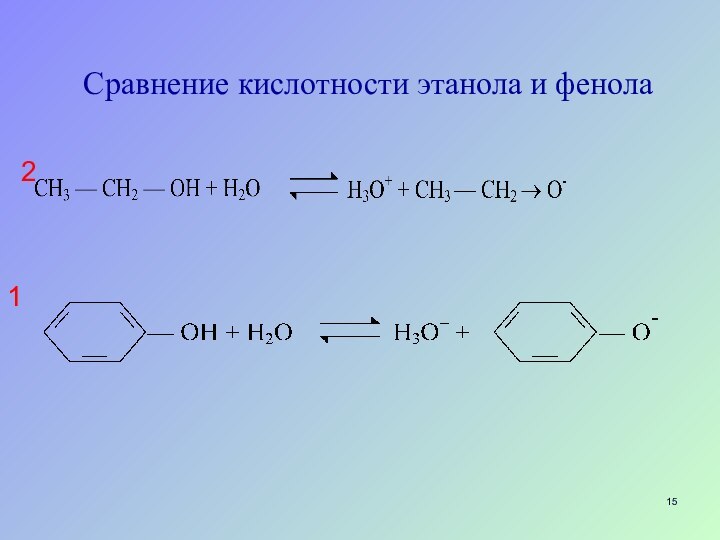
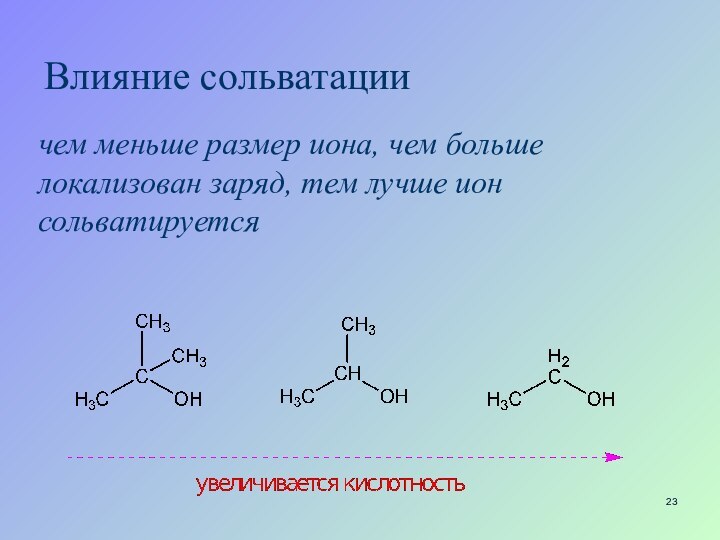
Слайд 23
Влияние сольватации
чем меньше размер иона, чем больше
локализован заряд, тем лучше ион сольватируется
Слайд 25
Основность по Бренстеду
CH3OH
молекулы
- это способность присоединять протон
основания
анионы
CH3O-
Слайд 26
В зависимости от природы гетероатома
n-основания
π-основания
аммониевые
оксониевые
тиониевые
основания
Слайд 27
чем выше рКвн+, тем сильнее основание
рКвн+ =
-lg Квн+
рКвн+ - количественная характеристика основности
Слайд 28 Качественная характеристика основности – величина электронной плотности на
основном центре
Чем выше электронная плотность на основном центре, тем
сильнее основание
Слайд 30
Влияние радикала
1
2
электронодонорные заместители повышают основность, электроноакцепторные - понижают
3
Слайд 39
Амфотерность органических соединений
спирты
гидроксикислоты
фенолокислоты
аминокислоты
пуриновые и пиримидиновые основания
Слайд 45
Электронная теория Льюиса
кислота — акцептор пары электронов
основание
— донор пары электронов
Слайд 46
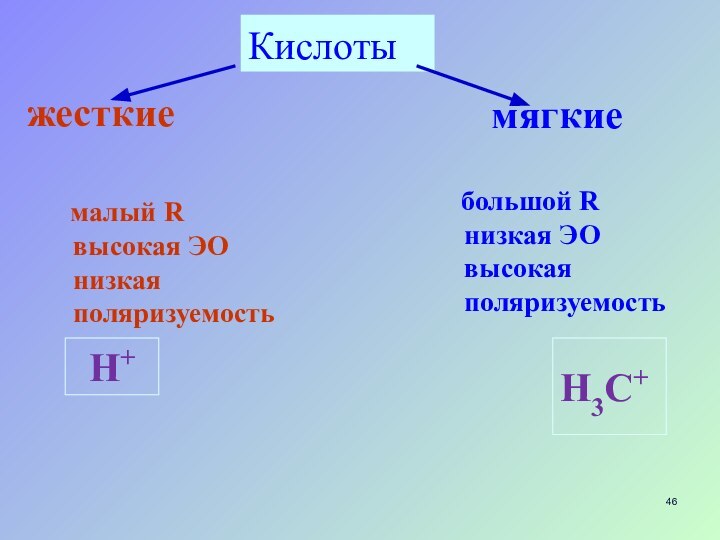
Кислоты
жесткие
мягкие
малый R
высокая ЭО
низкая
поляризуемость
большой R
низкая ЭО
высокая поляризуемость
H+
H3C+
Слайд 47
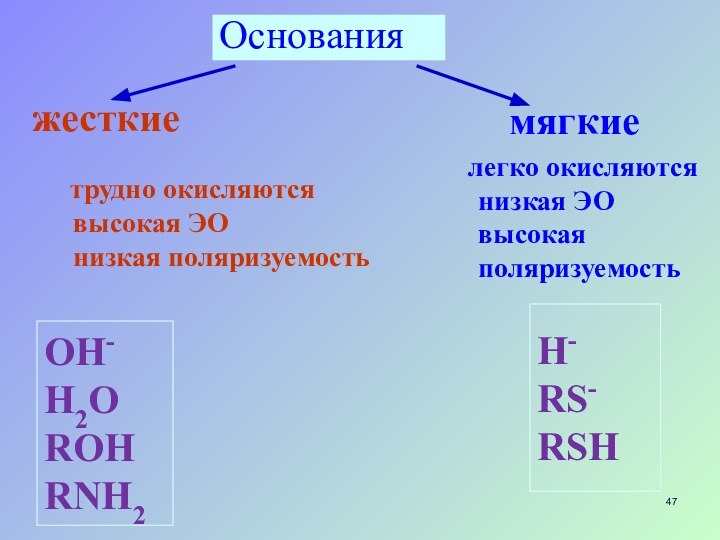
Основания
жесткие
мягкие
трудно окисляются
высокая ЭО
низкая
поляризуемость
легко окисляются
низкая ЭО
высокая поляризуемость
OH-
H2O
ROH
RNH2
H-
RS-
RSHСлайд 48 ПЖМКО –принцип жестких и мягких кислот и оснований
(Пирсона): жесткие кислоты будут преимущественно связываться с жесткими основаниями, а
мягкие кислоты – с мягкими основаниями
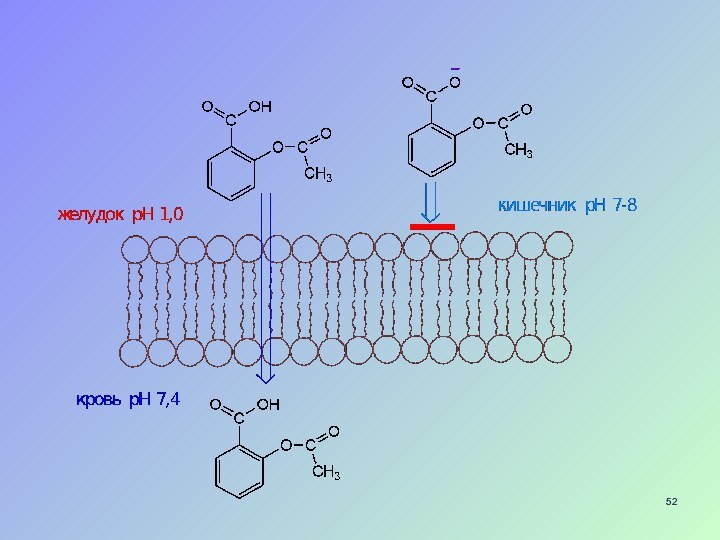
Слайд 50
Кислотность, основность в биологических системах
Большинство БВС и лекарственных
средств – слабые кислоты или основания
Важное значение имеет степень
ионизации соединения в определенной средеРазличия в степени ионизации обеспечивают избирательность действия
Слайд 51
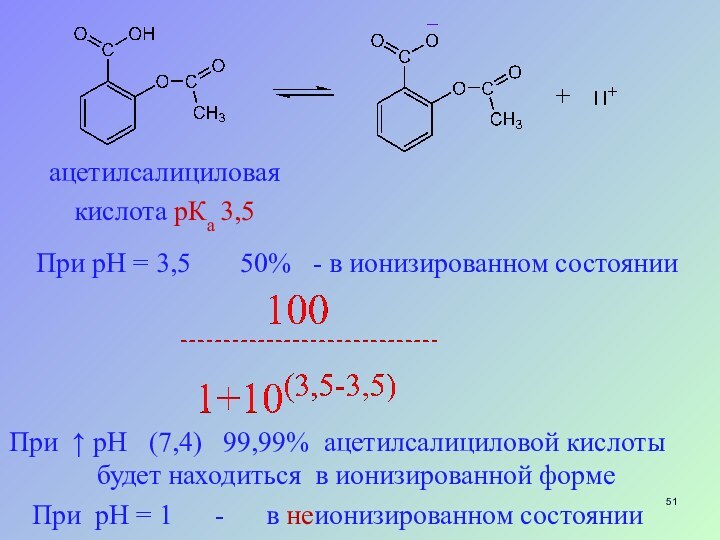
ацетилсалициловая
кислота рКа 3,5
При рН = 3,5
50% - в ионизированном состоянии
При ↑
рН (7,4) 99,99% ацетилсалициловой кислоты будет находиться в ионизированной формеПри рН = 1 - в неионизированном состоянии
Слайд 54 В органической химии субстрат – это соединение, молекула
которого поставляет атом углерода для образования связи
Реагент – это
действующее на субстрат веществоМеханизм реакции – детальное описание процесса в результате которого исходные вещества превращаются в конечные продукты
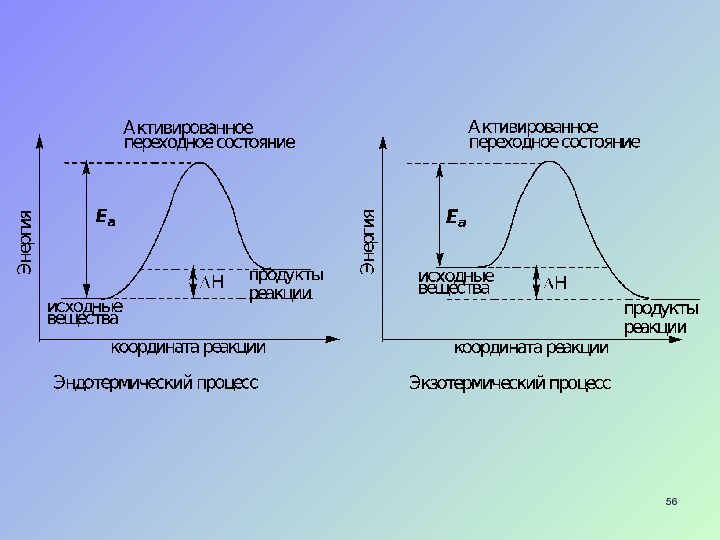
Слайд 55 Для того чтобы осуществилась реакция, необходимо столкновение двух
частиц, обладающих энергией, достаточной для преодоления энергетического барьера реакции
Энергия необходимая для образования активированного комплекса называется энергией активации (Еа)
Слайд 57 По направлению реакций с учетом конечного результата:
Классификация органических реакций
р. замещения
Substitution - Sр. присоединения Addition -A
р. отщепления Elimination -E
р. перегруппировки Isomerisation -I
Слайд 59
мономолекулярные
бимолекулярные
По числу молекул, участвующих в стадии, определяющей
скорость реакции:
Слайд 61
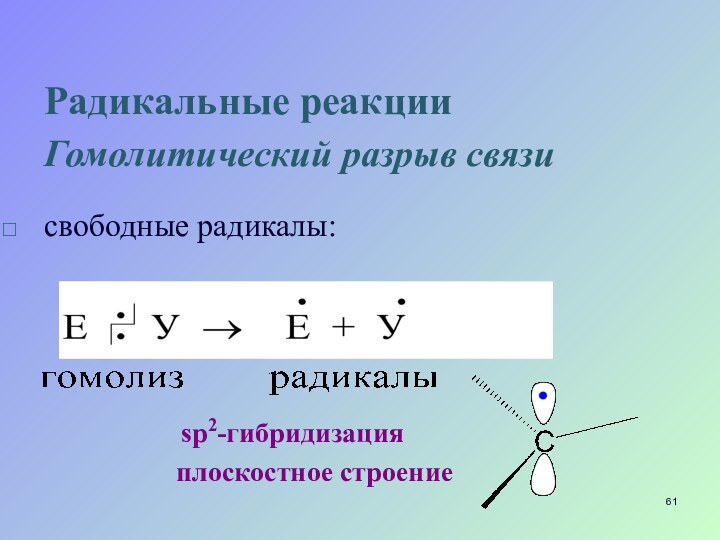
Радикальные реакции
Гомолитический разрыв связи
свободные радикалы:
sp2-гибридизация
плоскостное строение
Слайд 62
Признаки радикальных реакций
1.гомолитически разрывается неполярная ков. связь
2.реакции протекают
в газовой фазе или в неполярных растворителях 3.инициируются физическими (излучения,
t), а также химическими факторами (R-O-O-R, Fe2+)Слайд 63 4. чувствительны к действию акцепторов электронов 5. являются
цепными самоускоряющимися рекциями Стадии радикальных реакций: 1.
инициирование радикалов 2. рост цепи 3. обрыв цепиПризнаки радикальных реакций
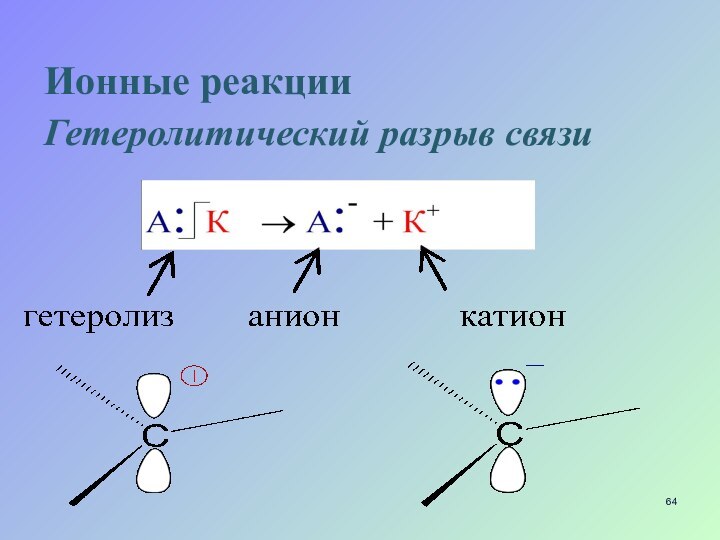
Слайд 65
Реагенты:
Нуклеофильные реагенты Nu
Образуют новые ковалентные связи
с партнером, предоставляя для этого пару электронов
а) отрицательно заряженные
ионы :Н :Вr :ОН :OR :SН :SR
б) молекулы, имеющие неподеленную пару электронов
HOH ROH RNH2 RSH
Слайд 66
Реагенты:
Электрофильные Е
Образуют новые ковалентные связи
за счет пары электронов партнера
а) положительно заряженные ионы
Н+ Н3С + Н5С2+
б) молекулы с частичным положительным зарядом на одном из атомов
Слайд 67
Признаки ионных реакций
1. гетеролитически разрывается полярная ков. связь
2. реакции протекают в полярных растворителях 3. катализируются кислотами
или основаниями
Слайд 71
тиолы в мягких условиях окисляются до дисульфидов
тиолы окисляются
легко
[O]
диалкилдисульфид
Антиоксиданты – вещества, препятствующие окислению
Слайд 73 Степень ионизации зависит от рН раствора и рКа
кислоты (или рКвн+ основания)
Степень ионизации кислоты =
(% анионной формы)
Степень ионизации основания =
(% катионной формы)





























