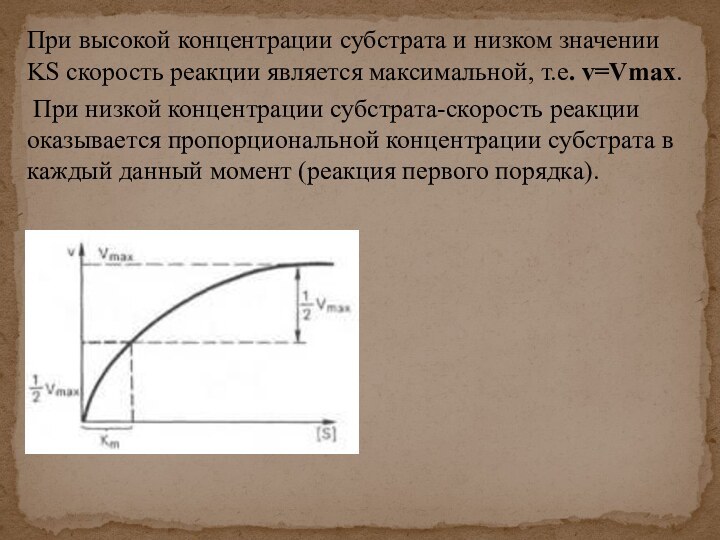
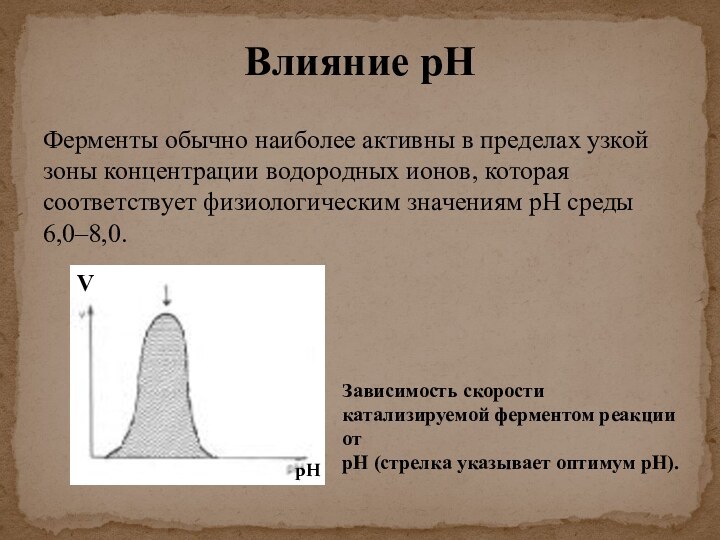
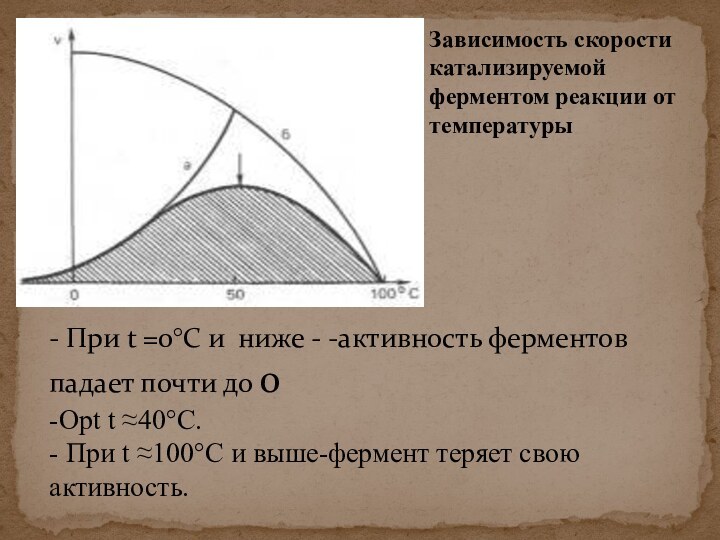
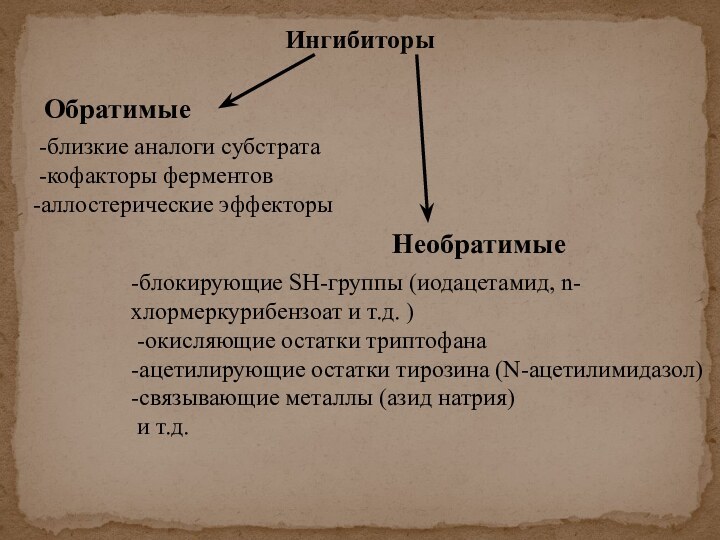
скорости химических реакций, катализируемых ферментами, от химической природы реагирующих
веществ, а также от факторов окружающей среды.Математически скорость ферментативной реакции выражается в изменении концентрации субстрата (уменьшение) или продукта (увеличение) за единицу времени:
V= D[S]/t = D[P]/t.



![Кинетика ферментативных реакций При низкой концентрации субстрата :где [S] – молярная концентрация субстрата S; -d[S]/dt](/img/tmb/13/1233161/139a5cd21c7e6b72dc7c819313d4dedc-720x.jpg)