- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Общие свойства металлов и сплавов
Содержание
- 2. Общие свойства металлов и сплавов.
- 3. ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ Согласно закономерностям изменения свойств
- 4. Степени окисления металловО, +1, +2, +3 — основные. Характерны только восстановительные свойства.
- 5. Основные особенности строения атомов металлов1. Небольшое число
- 6. -- 1. нейтральные атомы. 2. положительнозаряженные ионы.
- 7. СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК АТОМОВ Состояние
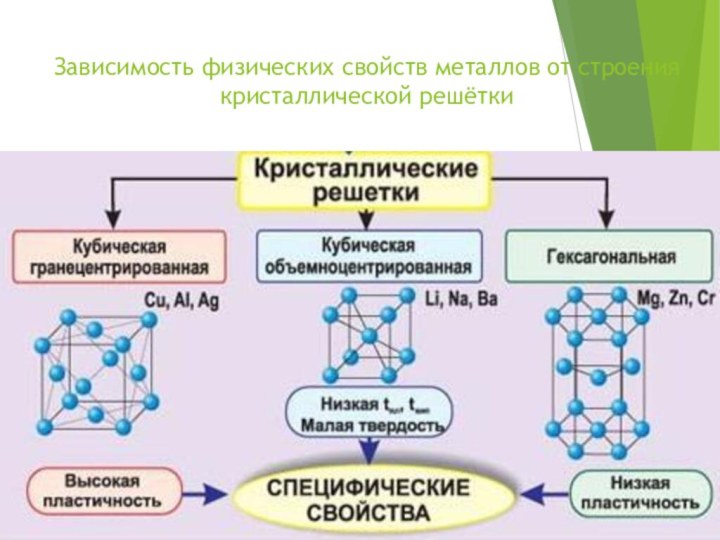
- 9. Зависимость физических свойств металлов от строения кристаллической решётки
- 10. Металлический блескметаллический блеск – электроны, заполняющие межатомное
- 11. Ковкость
- 12. Обладают тепло- и электропроводностьюХаотически движущиеся электроны под
- 13. РтутьВольфрам
- 14. ТанталЛитий
- 15. СереброПлатинаЗолото
- 16. Уран
- 17. БериллийХромИндийНатрий
- 18. Магнитные свойства металловФерромагнетики – металлы
- 21. Сплавы металлов Сплавы -
- 22. Виды и свойства чугунов.
- 24. Скачать презентацию
- 25. Похожие презентации
Общие свойства металлов и сплавов.
















Слайд 4
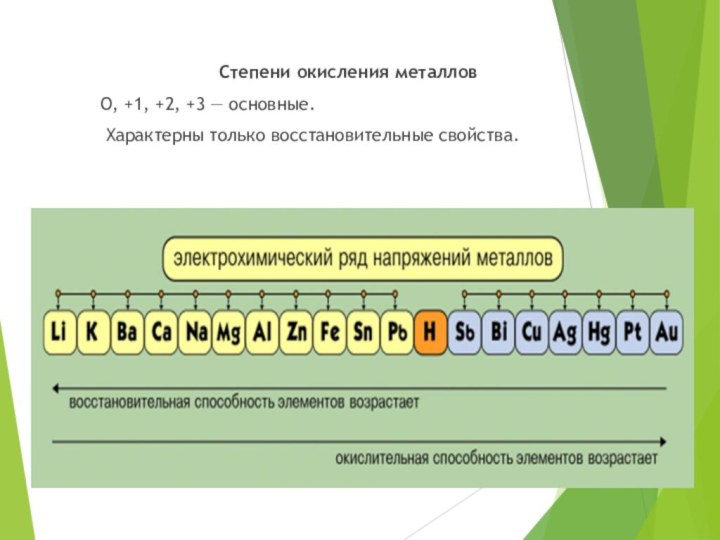
Степени окисления металлов
О, +1, +2, +3 —
основные.
Характерны только восстановительные свойства.
Слайд 5
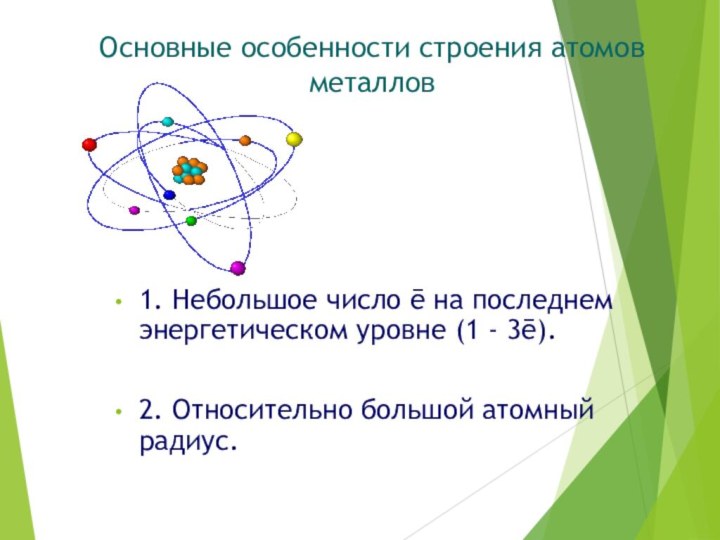
Основные особенности строения атомов металлов
1. Небольшое число ē
на последнем энергетическом уровне (1 - 3ē).
2. Относительно большой
атомный радиус.
Слайд 6
-
-
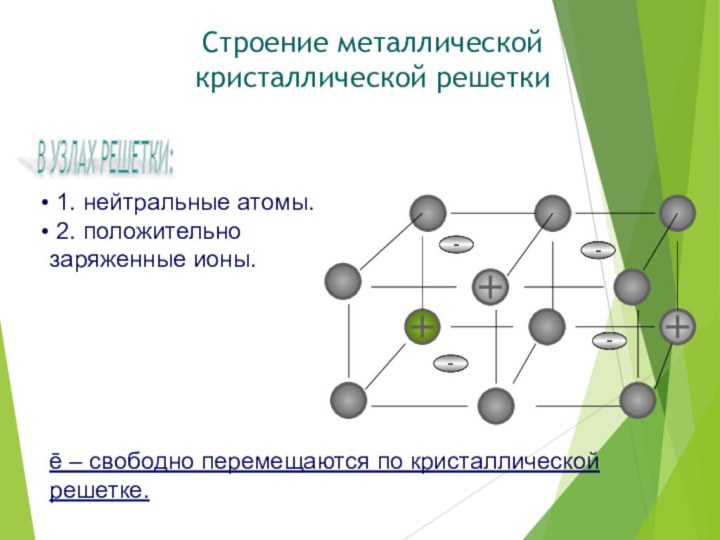
1. нейтральные атомы.
2. положительно
заряженные ионы.
ē
– свободно перемещаются по кристаллической решетке.
В УЗЛАХ РЕШЕТКИ:
Строение
металлической кристаллической решетки-
-
Слайд 7
СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК АТОМОВ
Состояние
электрона в атоме, как и других микрочастиц, описывается основными
положениями квантовой механики. Электрон, согласно квантовомеханическим представлениям, является частицей, так как имеет массу покоя и заряд. В то же время он имеет волновой характер, так как его движение характеризуется длиной волны, частотой, явлениями дифракции и интерференции.Согласно вероятностного подхода математически можно определить не точное положение электрона в атоме, а вероятность его нахождения в той или иной области околоядерного пространства.
Поэтому состояние электрона (совокупность информации о его энергии и о пространстве, в котором он находится) описывается с помощью квантовомеханической модели — электронного облака.
Электронное облако и электронная орбиталь
Электронное облако — это модель, отражающая совокупность вероятностных положений электрона в разных частях околоядерного пространства.
Электронное облако не имеет четких границ и неравномерно по плотности.
Атомная электронная орбиталь — область околоядерного пространства
(≈ 90%), в которой наиболее вероятно нахождение данного электрона.
Слайд 10
Металлический блеск
металлический блеск – электроны, заполняющие межатомное пространство
отражают световые лучи, а не пропускают как стекло. Поэтому
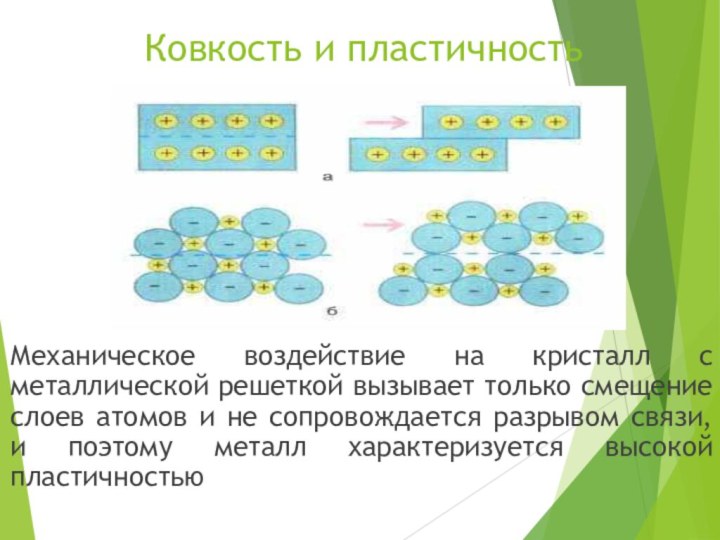
все металлы в кристаллическом состоянии имеют металлический блеск.Слайд 11 Ковкость и
пластичность
Механическое воздействие на кристалл с металлической решеткой вызывает только
смещение слоев атомов и не сопровождается разрывом связи, и поэтому металл характеризуется высокой пластичностью
Слайд 12
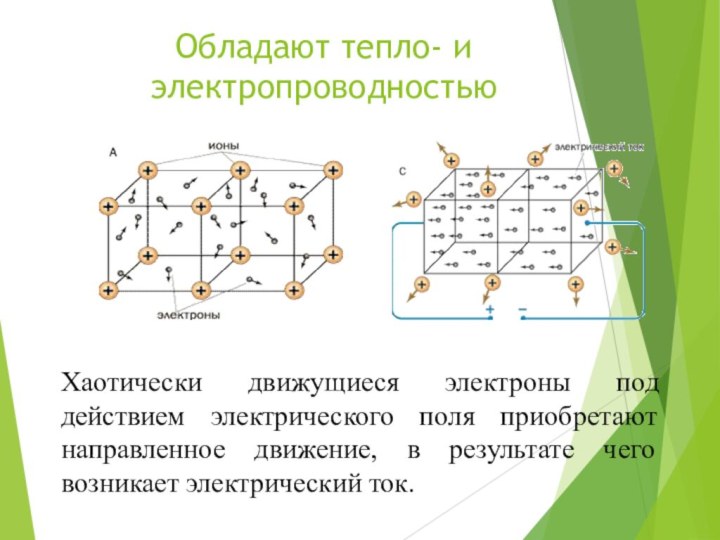
Обладают тепло- и электропроводностью
Хаотически движущиеся электроны под действием
электрического поля приобретают направленное движение, в результате чего возникает
электрический ток.
Слайд 18
Магнитные свойства металлов
Ферромагнетики – металлы способные
сильно намагничиваться и долго сохранять это свойство (Fe, Co,
Ni).Парамагнетики – слабо намагничиваются и не сохраняют это состояние вне магнитного поля (щелочные, щелочно-земельные и большая часть переходных металлов).
Диамагнетики – металлы, выталкиваемые магнитным полем (Cu, Аg, Au, Bi).
Слайд 21
Сплавы металлов
Сплавы - (твердые
растворы) — это системы, состоящие из двух и более
металлов или металлов и неметаллов.! Сплавы отличаются по физическим свойствам от металлов, их образующих. Это объясняется изменением строения кристаллов сплавов по сравнению со строением образующих его металлов.
Например:
Сплав Вуда: tпл = 68 °, а температуры плавления металлов, образующих сплав:
Bi—271,0 °С; РЬ — 327,4 °С; Sn—231,9 °С; Cd— 321 °С.
Латунь: обладает большей твердостью, чем исходные металлы, образующие сплав (Си и Zn)-
Черные сплавы — сплавы, получаемые на основе железа, — чугун и сталь.
Цветные сплавы — сплавы, полученные на основе меди (основной компонент), латуни, бронзы.
Легкие сплавы — сплавы на основе магния или алюминия — дуралюмин, магналий.
Благородные и редкие сплавы — сплавы на основе драгоценных и редких металлов — ювелирные сплавы.





























