- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Алкены
Содержание
- 2. План урокаНепредельные углеводороды Общая формула Изомерия Гомологический ряд Номенклатура Получение
- 3. Непредельные углеводородыНепредельными называются углеводороды, в молекулах которых
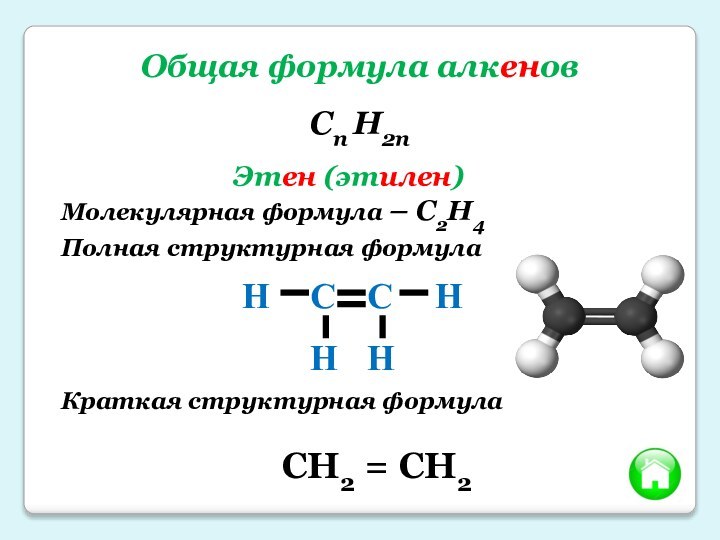
- 4. Общая формула алкеновCn H2n Этен (этилен)Молекулярная формула – C2H4Полная структурная формулаКраткая структурная формулаCH2 = CH2
- 5. Изомерия а) структурная - или изомерия углеродной
- 6. Гомологический ряд
- 7. Номенклатура
- 8. Получение углеводородов ряда этилена1.Крекинг (расщепление при высокой
- 9. Физические свойстваС2H4 до C4H8 -
- 10. Химические свойства определяются наличием двойной связи.Характерные
- 11. Химические свойства3. Присоединение галогеноводородов – реакция протекает
- 12. Химические свойстваРеакции окисления5. Мягкое окисление – характерная
- 13. Химические свойства7. Реакции полимеризациипроцесс соединения одинаковых молекул в
- 14. а) в природе находится в небольших количествах
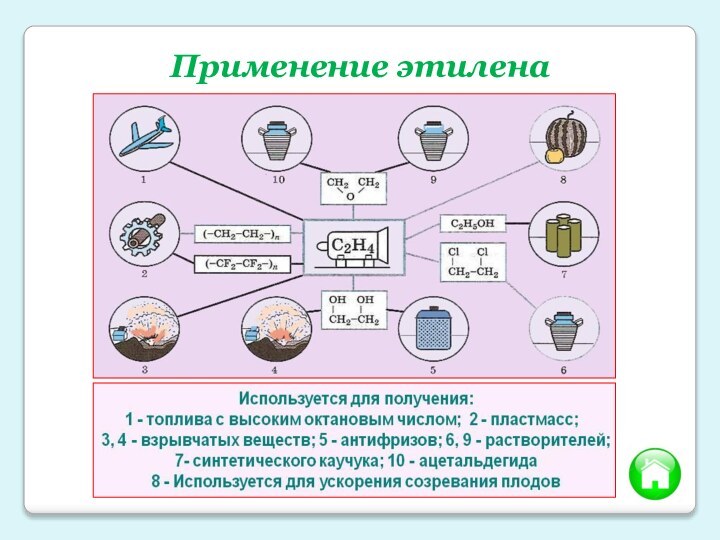
- 15. Применение этилена
- 16. Скачать презентацию
- 17. Похожие презентации
План урокаНепредельные углеводороды Общая формула Изомерия Гомологический ряд Номенклатура Получение углеводородов ряда этилена Физические свойства Химические свойства Отдельный представитель - Этен или этилен123456789ДЗ














Слайд 2
План урока
Непредельные углеводороды
Общая формула
Изомерия
Гомологический ряд
Номенклатура
Получение углеводородов
ряда этилена
Слайд 3
Непредельные углеводороды
Непредельными называются углеводороды, в молекулах которых имеются
атомы углерода, связанные между собой двойной или тройной связью.
Алкены.
Углеводороды ряда этилена – это непредельные углеводороды в молекулах которых имеются два атома углерода, связанные двойной связью
CH2 = CH2
Слайд 4
Общая формула алкенов
Cn H2n
Этен (этилен)
Молекулярная формула – C2H4
Полная структурная
формула
Краткая структурная формула
CH2 = CH2
Слайд 5
Изомерия
а) структурная - или изомерия углеродной цепи
Для этого одну из групп CH2 вынесем за пределы линейной молекулы, она превратится в радикал CH3, так как у углерода валентность всегда =4
1 2 3 4
CH3–C= CH - CH3 назовем эту молекулу: 2 метил бутен -2
|
CH3
(Пояснение: первая цифра 2 показывает около какого атома углерода (С) расположен радикал метил - CH3 , последняя цифра 2 показывает после какого по счету атома углерода стоит двойная (кратная) связь =.
б) изомерия положения двойной (=) связи
1 2 3 4 5
CH 2=CH – CH2 – CH2 – CH3 бутен -1, т.к. = связь стоит после 1 атома углерода (С)
1 2 3 4 5
CH3 – CH = CH – CH 2- CH3 бутен – 2, т.к. = связь стоит после 2 атома углерода
Слайд 7
Номенклатура
6 5
4 3 2 1CH3- CH- CH2- C = CH - CH3
| |
CH3 CH2
|
CH3
5 метил 3 этилгексен-2
Нумеруем с того конца, где находится двойная связь
Называть начинаем с младшего радикала-заместителя
Слайд 8
Получение углеводородов ряда этилена
1.Крекинг (расщепление при высокой температуре)
или пиролиз нефти
2.Крекинг угля
3. Крекинг предельных углеводородов
tC18H38 → C9H18+C9H20
нонен нонан
4. Дегидратация спиртов – отнятия молекулы воды (Н2О) у спирта
t=350 конц. серная кислота
CH2 - CH2 → CH2 = CH2 + H2O
| |
H OH
5. Дегидрирование алканов – отщепление водорода (Н2) от молекулы алканов
t=500
CH3 - CH - CH3 → CH2= C –CH3 + H2
| |
CH3 CH3
Слайд 9
Физические свойства
С2H4 до C4H8 - газы
C5 H10
до C18H36 - жидкости
C19H38 и т.д.
- твердые веществаТемпература их плавления и кипения, а также плотность увеличиваются с ростом молекулярной массы.
Все они легче воды, плохо растворимы в ней, однако растворимы в органических растворителях.
Слайд 10
Химические свойства определяются наличием двойной связи.
Характерные
реакции - присоединение, окисление, полимеризация.
Реакции присоединения:
1. Гидрирование - присоединение
водорода (Н2 ) Ni 30-500C
CH 3 - CH = CH2 + H2 → CH3 - CH 2 - CH3
2. Реакция галогенирования - присоединение галогенов
(характерная реакция – обесцвечивание бромной воды)
CH2=CH2 + Br2 → CH2 - CH2
| |
Br Br
Этен 1,2-дибромэтан
Химические свойства
Слайд 11
Химические свойства
3. Присоединение галогеноводородов – реакция протекает по
ионному механизму H+Br –
CH3 – CH = CH2 + HBr → CH3– CHBr – CH3Правило Морковникова: атом водорода присоединяется к наиболее гидрированному атому углерода
H Н H
| | |
H - C – C = C-H + HBr → CH3– CHBr – CH3
|
H
4. Реакция гидратации – присоединение воды
СH2=CH2+ H2O 600 C ZnCl CH3 – CH2 – OH
Этен этиловый спирт
Слайд 12
Химические свойства
Реакции окисления
5. Мягкое окисление – характерная реакция-
обесцвечивание раствора марганцовки.
KMnO4CH2 =CH2 + [ O ] + H2O → CH2 - CH2
| |
OH OH
Этиленгликоль
(двухатомный спирт)
6. Горение
CH2=CH2 + 3O2 → 2 CO2 + 2H2O +Q
Слайд 13
Химические свойства
7. Реакции полимеризации
процесс соединения одинаковых молекул в более
крупные называется полимеризацией , а продукт этой реакции полимером.
k 200C СH2=CH2 + CH2=CH2 + CH2=CH2 + …… → -CH2-CH2-CH2-CH2-CH2-CH2-
этилен
….→ (-CH2-CH2-)n
полиэтилен, где
СH2=CH2 - мономер
(-CH2-CH2-)n -полимер
(-CH2-CH2-) -структурное звено
n -степень полимеризации
Слайд 14 а) в природе находится в небольших количествах в
природном и светильном газе
б) в лабораториях получают реакцией дегидратации
этилового спиртав) физические свойства - газ, без цвета, запах сладковатый.
г) горит светящимся слабо коптящим пламенем, при смешивании с воздухом образует взрывчатую смесь
д) обладает наркотическими свойствами
Этен или этилен