- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості
Содержание
- 2. Мета.Поглибити уявлення про гомологічні ряди вуглеводнів –
- 3. Види сполучень атомів Карбону між собою1. Сполучення
- 4. Структурні формули органічних речовинАлкани – насичені вуглеводні
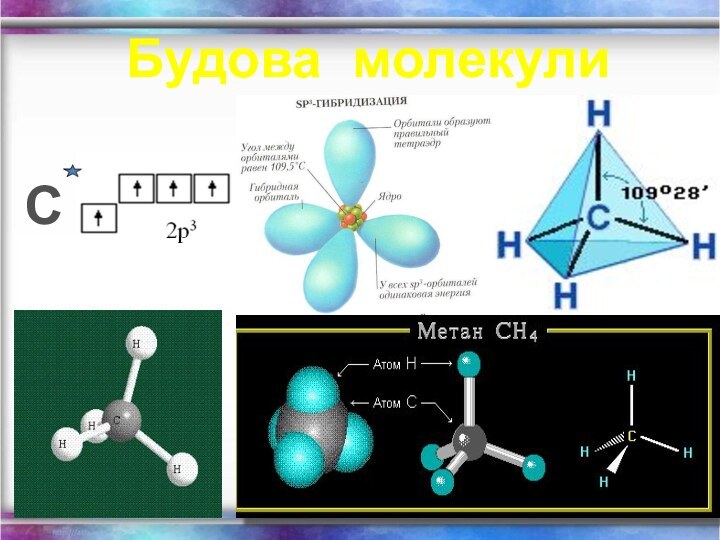
- 5. Будова молекулиС
- 6. Фізичні властивості метану: Метан (СН4) -
- 8. Ненасичені вуглеводні – органічні сполуки, що мають
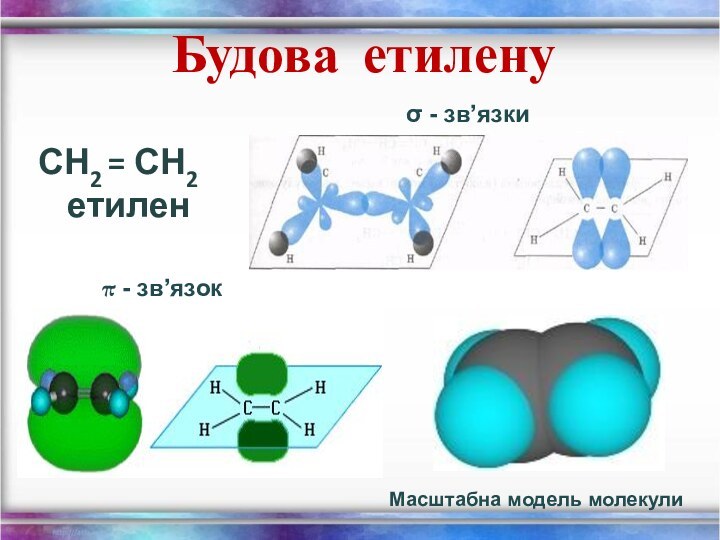
- 10. Будова етиленуСН2 = СН2 етиленσ - зв’язкиπ - зв’язокМасштабна модель молекули
- 11. Фізичні властивості етиленуС2Н4безбарвний газ;добре розчинний в органічних розчинниках;tплавл = - 169,2 ̊С; вибухонебезпечний
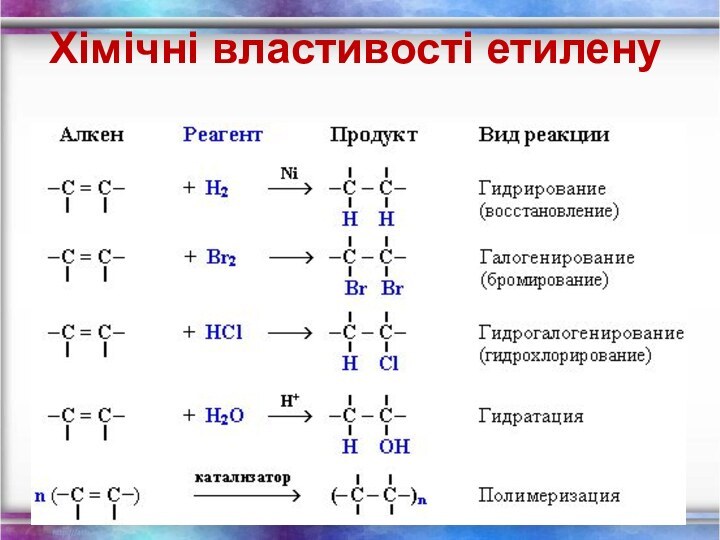
- 12. Хімічні властивості етиленуГоріння (з виділенням великої кількості
- 13. Хімічні властивості етилену
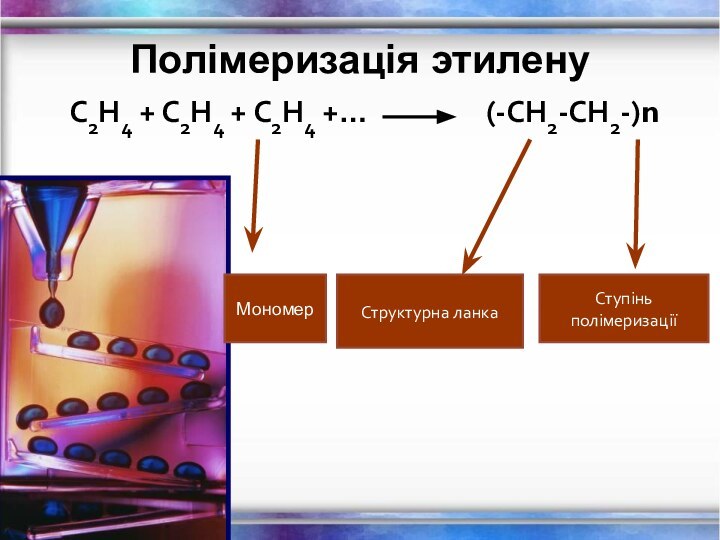
- 14. Полімеризація этилену С2Н4 + С2Н4 + С2Н4
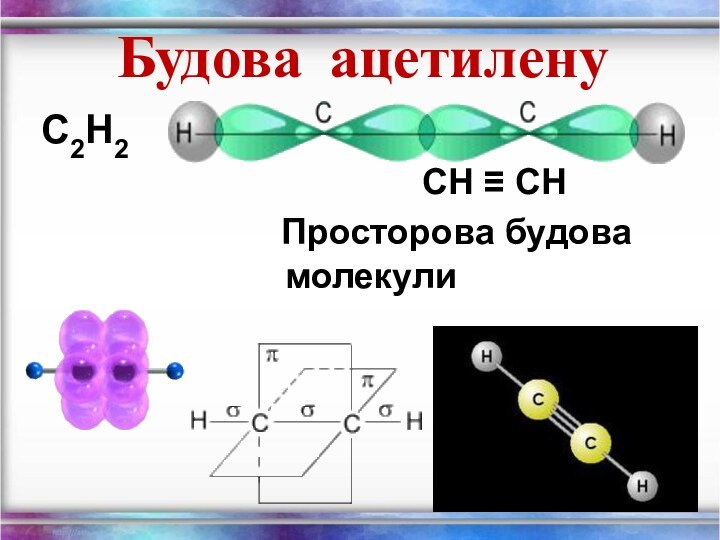
- 15. Будова ацетилену С2Н2
- 16. Фізичні властивостіС2Н2 безбарвний газ;майже без запаху;малорозчинний у
- 17. Хімічні властивості ацетиленуГоріння (яскравим кіптявим полум’ям): 2С2Н2
- 18. Порівняльна таблиця
- 19. АЛКАНИ CnH2n + 2 H2
- 20. АЛКЕНИ СnH2n H2
- 21. АЛКАНИ CnH2n +
- 22. Структурна формула бензенуАрени – ненасичені вуглеводні із
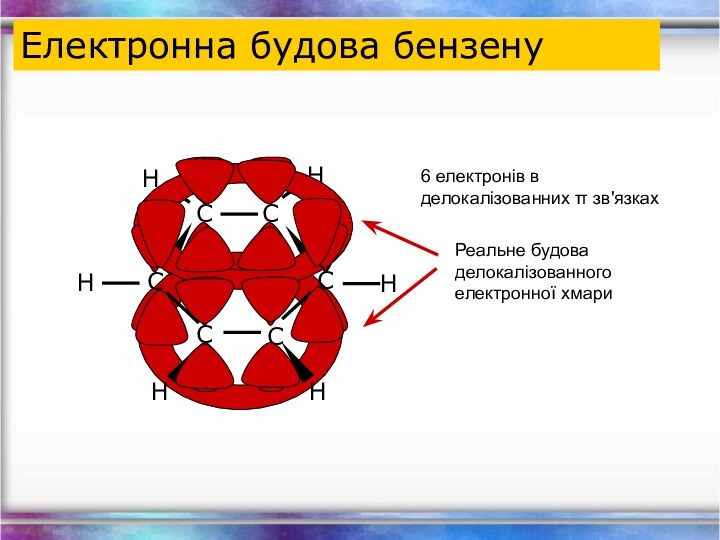
- 23. Електронна будова бензену6 електронів в делокалізованних π зв'язках
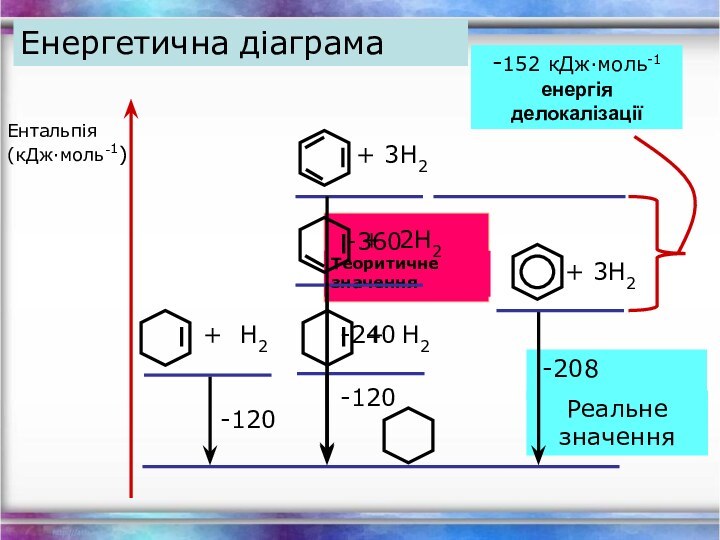
- 24. Енергетична діаграмаЕнтальпія (кДж∙моль-1)-120-208-152 кДж∙моль-1енергія делокалізації
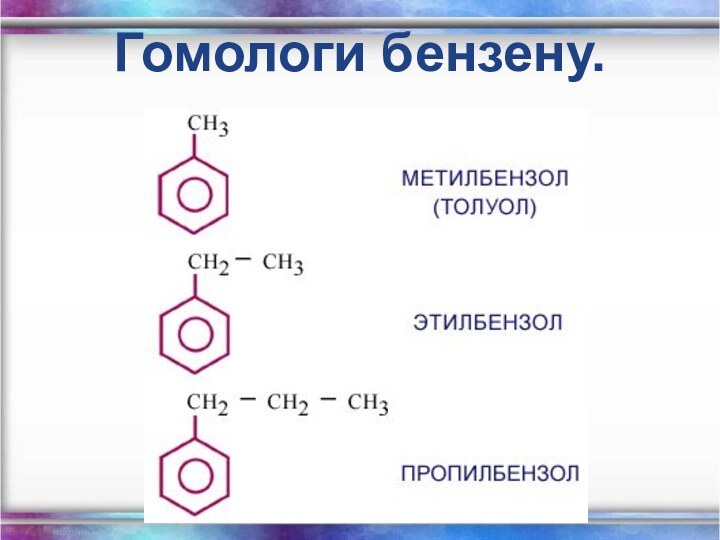
- 25. Гомологи бензену.
- 26. Отримання бензену.Бензен є першим представником аренів. Його
- 27. Физические свойства бензола.Бензен:безбарвна рідина,з різким характерним
- 28. Бензол горить. Полум'я бензолу кіптяве з-за високого
- 29. Хімічні властивості бензолу 2. Реакції заміщення в
- 30. 2. Реакції заміщення б) реакція нітрування
- 31. Хімічні властивості бензолу 3. Реакції приеднання в
- 32. Хімічні властивості бензолуНезважаючи на високу ненасиченість молекули
- 33. Застосування бензену1-добавка до бензину;виробництво2-розчинників;3-ацетону;4-аніліну;5-фенолу;6-пестицидів;7-ліків; 8-фенолформальдегідних пластмас.
- 34. ЗАВДАННЯ (І РІВЕНЬ)1. Розподіліть по класам
- 35. ЗАВДАННЯ (ІI РІВЕНЬ)1. Визначіть речовини, встановіть клас
- 36. ЗАВДАННЯ (ІII РІВЕНЬ)1. Розподіліть по класам і
- 37. Скачать презентацию
- 38. Похожие презентации




















Слайд 2
Мета.
Поглибити уявлення про гомологічні ряди вуглеводнів – алкани,
алкени, алкіни, арени.
та хімічними властивостями вуглеводнів, основними типами характерних реакцій.
Слайд 3
Види сполучень атомів Карбону між собою
1. Сполучення простими
ковалентними зв’язками:
– С – С –
С – С –Такі сполучення реалізуються навіть
у простих речовинах Карбону:
алмазі, графіті, карбіні, фулеренах.
2. Сполучення кратними (подвійними і потрійними) ковалентними зв’язками:
– С = С – С = С – – С ≡ С –
3. Циклічне сполучення атомів Карбону:
Алмази:
Фулерени:
Слайд 4
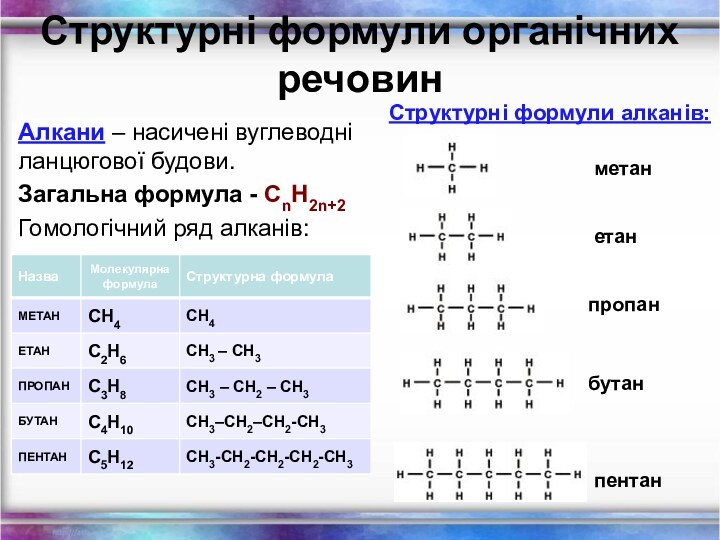
Структурні формули органічних речовин
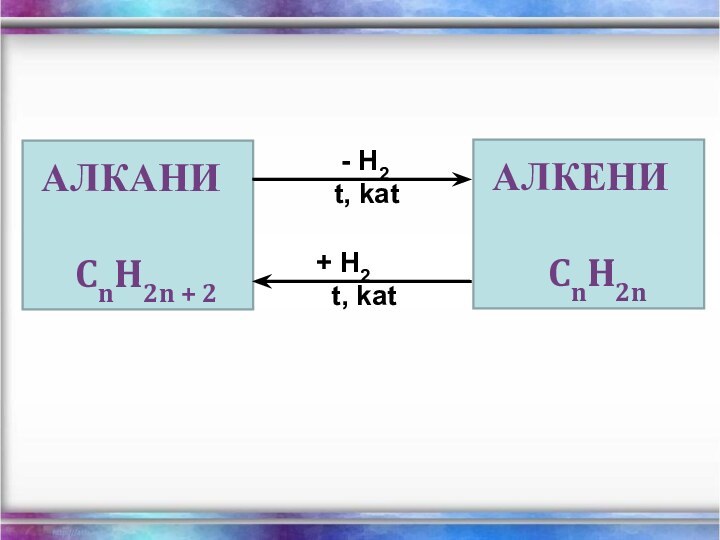
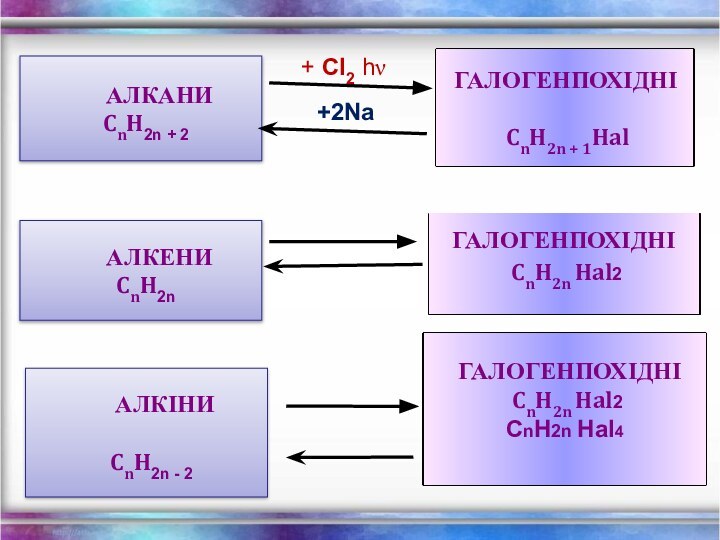
Алкани – насичені вуглеводні ланцюгової
будови.
Загальна формула - СnH2n+2
Гомологічний ряд алканів:
метан
етан
пропан
бутан
пентан
Структурні формули алканів:
Слайд 6
Фізичні властивості метану:
Метан (СН4) -
газ;
без кольору;
без запаху;
майже не
розчиняється у воді;tкипіння = - 161,6 ̊С;
tплавлення = - 182,5 ̊С.
Слайд 7
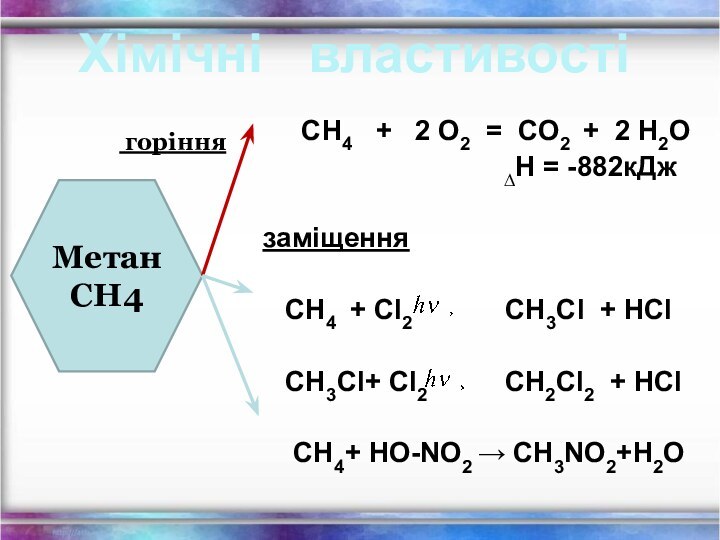
СН4 + 2 О2 = СО2 + 2 Н2О
∆Н = -882кДж
заміщення
СН4 + Cl2 СН3Cl + HCl
СН3Cl+ Cl2 СН2Cl2 + HCl
СН4+ HO-NO2 → СН3NO2+Н2О
Хімічні властивості
Метан
СН4
горіння
Слайд 8
Ненасичені вуглеводні – органічні сполуки, що мають кратні
зв’язки між атомами Карбону (подвійні – С = С
– або потрійні – С Ξ С – )Етиленові вуглеводні - органічні сполуки, що мають один подвійний зв’язок між атомами Карбону.
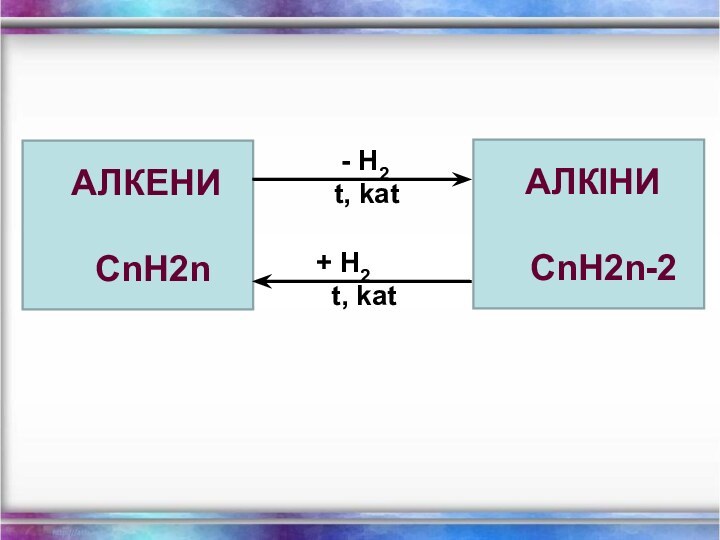
Загальна формула СnH2n
С2Н4 - етен (етилен)
С3Н6 - пропен
С4Н8 - бутен
Ацетиленові вуглеводні - органічні сполуки, що мають один потрійний зв’язок між атомами Карбону.
Загальна формула - СnH2n - 2
С2Н2 - етин (ацетилен)
С3Н4 - пропін
С4Н6 - бутин
Слайд 9
загальна формула
кратні зв'язки
тип гібридизації
кут між напрямами зв'язку
Алкени
Алкіни
CnH2n
CnH2n-2
sp2
sp
1s + 2p = 3sp2
1s + 1p = 2sp
< 120◦
< 180◦
Ненасичені вуглеводні
Слайд 11
Фізичні властивості етилену
С2Н4
безбарвний газ;
добре розчинний в органічних розчинниках;
tплавл
= - 169,2 ̊С;
вибухонебезпечний
Слайд 12
Хімічні властивості етилену
Горіння (з виділенням великої кількості теплоти):
С2Н4 + 3O2 → 2СО2 +2Н2О
2. Реакції приєднання по
місцю розривуπ - зв’язку: СН2 = СН2
а) гідрування - приєднання водню: С2Н4 + Н2→ С2Н6
б) галогенування - приєднання галогенів:
С2Н4 + Br2 →С2Н4Br2
Якісне визначення ненасичених
вуглеводнів - знебарвлення розчину
калій перманганату і бромної води
Слайд 14
Полімеризація этилену
С2Н4 + С2Н4 + С2Н4 +…
(-СН2-СН2-)n
Структурна ланка
Ступінь
полімеризаціїМономер
Слайд 16
Фізичні властивості
С2Н2
безбарвний газ;
майже без запаху;
малорозчинний у воді,
але під тиском добре розчиняється у ацетоні;
tкип = -
84 ̊С; легший за повітря;
вибухонебезпечний
Слайд 17
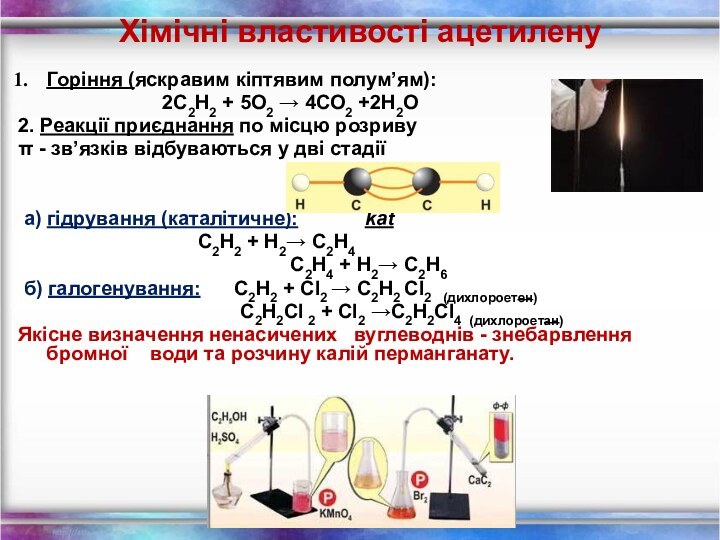
Хімічні властивості ацетилену
Горіння (яскравим кіптявим полум’ям):
2С2Н2 +
5O2 → 4СО2 +2Н2О
2. Реакції приєднання по місцю розриву
π
- зв’язків відбуваються у дві стадіїа) гідрування (каталітичне): kat
С2Н2 + Н2→ С2Н4
С2Н4 + Н2→ С2Н6
б) галогенування: С2Н2 + Cl2 → С2Н2 Cl2 (дихлороетен)
С2Н2Cl 2 + Cl2 →С2Н2Cl4 (дихлороетан)
Якісне визначення ненасичених вуглеводнів - знебарвлення бромної води та розчину калій перманганату.
Слайд 22
Структурна формула бензену
Арени – ненасичені вуглеводні із загальною
формулою CnH2n-6, молекули яких, містять бензольне кільце.
Молекулярна
формула бензену
формула
КекулеАроматичні вуглеводні
Слайд 26
Отримання бензену.
Бензен є першим представником аренів. Його можна
отримати трімерізаціей ацетилену.
Бензол отримують при переробці кам'яного вугілля,
а також при риформінгу бензинів з низьким октановим числом.
Слайд 27
Физические свойства
бензола.
Бензен:
безбарвна рідина,
з різким характерним запахом,
легше води,
розчиняється
у воді,
розчинний в органічних розчинниках.
Бензен токсичний, тому робота з
ним в умовах школи неприпустима.
Слайд 28
Бензол горить. Полум'я бензолу кіптяве
з-за високого вмісту
карбону в молекулі.
Химические
свойства бензола.
Через особливого будови молекули,
бензен займає проміжне положення між алканами і алкенами, тобто може вступати в реакції приєднання і в реакції заміщення.
Слайд 29
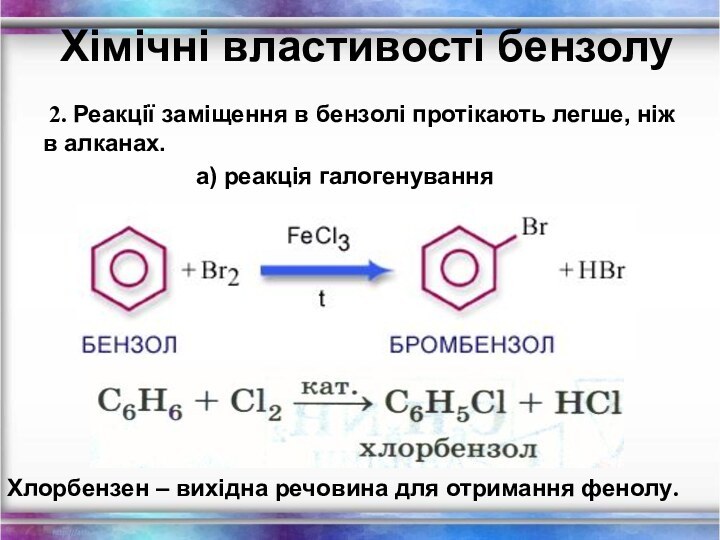
Хімічні властивості бензолу
2. Реакції заміщення в бензолі
протікають легше, ніж в алканах.
а) реакція галогенуванняХлорбензен – вихідна речовина для отримання фенолу.
Слайд 30
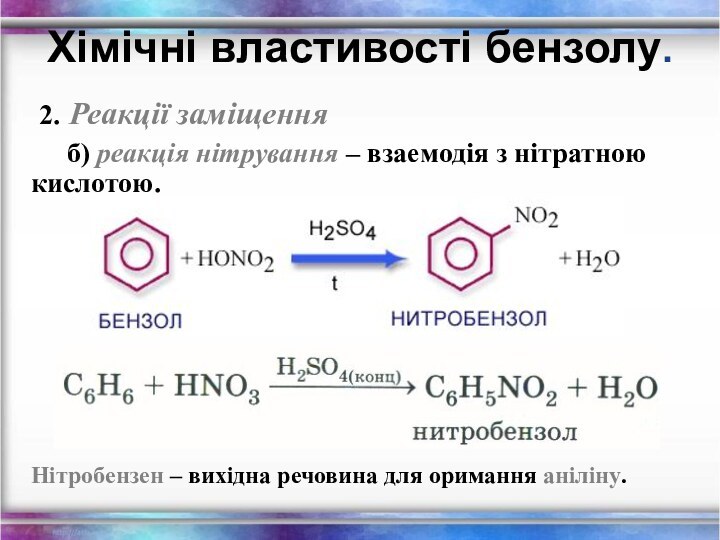
2. Реакції заміщення
б) реакція нітрування –
взаемодія з нітратною кислотою.
Хімічні властивості бензолу.
Нітробензен – вихідна
речовина для оримання аніліну.
Слайд 31
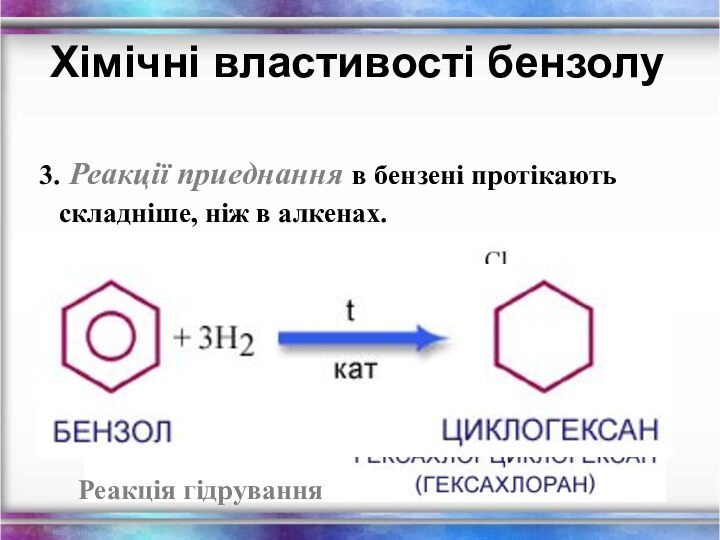
Хімічні властивості бензолу
3. Реакції приеднання в бензені
протікають
складніше, ніж в алкенах.
Реакція
гідрування
Слайд 32
Хімічні властивості бензолу
Незважаючи на високу ненасиченість молекули бензолу
(за складом), він не дає характерних, якісних реакцій для
ненасичених вуглеводнів: не знебарвлює бромну воду і розчин перманганату калію.Це пов'язано з особливою будовою молекули бензолу.
Слайд 33
Застосування бензену
1-добавка до бензину;
виробництво
2-розчинників;
3-ацетону;
4-аніліну;
5-фенолу;
6-пестицидів;
7-ліків;
8-фенолформальдегідних пластмас.
Слайд 34
ЗАВДАННЯ (І РІВЕНЬ)
1. Розподіліть по класам і
назвіть речовини:
а) С2Н2; б) С3Н8; в)
С6Н12; г) СН4; д) С4Н6 2.Встановіть відповідність між структурною формулою і назвою сполуки:
1) СН3 –СН = СН2 - СН2 - СН3; а) пентан;
2) СН 2 - СН 2 – СН2 - СН3; б) бутин;
3) СН ≡ С – СН 2 - СН3; в) бутан;
г) пентен
3. Допишіть рівняння реакцій:
а) СН4 + Br2 →
б) С3Н8 + O2 →
в) С2Н4 + Cl2 →
г) С2Н2 + Н2 →
Слайд 35
ЗАВДАННЯ (ІI РІВЕНЬ)
1. Визначіть речовини, встановіть клас сполук,
складіть їх структурні формули:
а)
б) в)2. Складіть структурні формули речовин:
а) 1-пропін; б) 2-бутен.
3. Допишіть рівняння реакцій, встановіть тип реакцій, назвіть речовини:
а) С2Н2 + Н2 → г) С2Н5Cl + Cl2 →
б) С3Н8 + O2 → д) СН4 + Br2 →
в) С2Н4 + Br2 → е) С3Н6 + Cl2 →
Слайд 36
ЗАВДАННЯ (ІII РІВЕНЬ)
1. Розподіліть по класам і назвіть
речовини:
а) б)
С3Н8; в) г) С3Н4; д) С4Н6; е)2. Встановіть відповідність між класом вуглеводню і типом хімічної реакції:
1) заміщення з бромом; а) пропін;
2) приєднання хлору; б) бутан;
3) полімеризація; в) бензен;
г) етен
3. Здійсніть перетворення, вкажіть тип реакцій, назвіть речовини:
а) C2H6 → C2H4 → CО2
б) CH4 → C2H2 → C2H2СІ2 → C2H4Cl2
↓
C2H5Br