- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Теория электролитической диссоциации (ТЭД).
Содержание
- 2. План урокаТеория электролитической диссоциации.I- е положение ТЭД.Задания
- 3. 1. Теория электролитической диссоциации (ТЭД).В 1887г. Шведский
- 4. 2. I-е положение ТЭД.
- 5. Вещества в растворахЭлектролиты(водные растворыпроводят эл.ток)Неэлектролиты (водные растворы
- 6. 3. Задания к I-му положению ТЭДКакие вещества
- 7. 4. II-е положение ТЭДВ растворах электролиты диссоциируют(
- 9. Механизм ЭД: Вещества с ионной связью:Ориентация диполей воды →гидратация →диссоциация.Вещества с ковалентной связью:Ориентация диполейводы →гидратация→ионизация→диссоциация
- 10. Типы ионовПо заряду: катионы (положительные) и анионы
- 11. Упрощённо процесс диссоциации изображают с помощью уравнений
- 12. Скачать презентацию
- 13. Похожие презентации
План урокаТеория электролитической диссоциации.I- е положение ТЭД.Задания к I-му положению ТЭД.II-е положение ТЭД.Задания к II-му положению ТЭД.










Слайд 2
План урока
Теория электролитической диссоциации.
I- е положение ТЭД.
Задания к
I-му положению ТЭД.
Слайд 3
1. Теория электролитической диссоциации (ТЭД).
В 1887г. Шведский учёный
С.Аррениус
для объяснения
особенностей водных растворов
веществ предложил теорию
электролитической диссоциации.
В
дальнейшем эта теория быларазвита многими учёными, в том
числе И.А. Каблуковым и
В.А. Кистяковским.
Сванте Аррениус
Слайд 4
2. I-е положение ТЭД.
Современное содержание
ТЭД можно
свести к четырем основным положениям.
I-е положение:
Все вещества
по их способностипроводить электрический ток в
растворах делятся на электролиты и
неэлектролиты.
Слайд 5
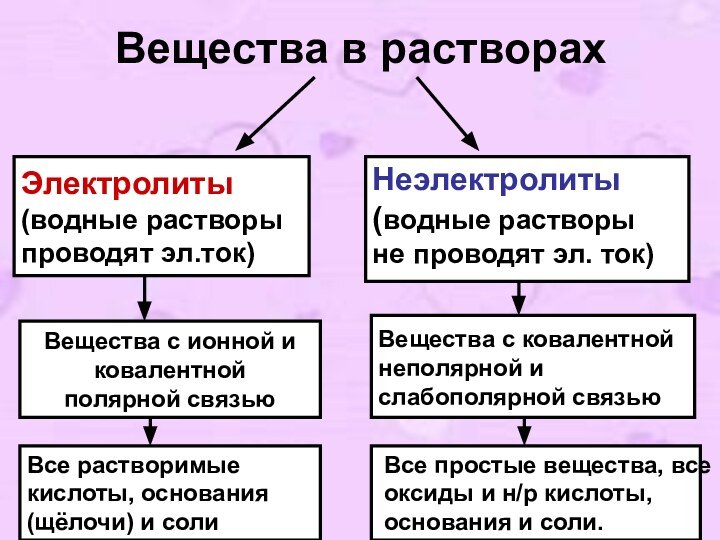
Вещества в растворах
Электролиты
(водные растворы
проводят эл.ток)
Неэлектролиты (водные растворы не
проводят эл. ток)
Вещества с ионной и
ковалентной
полярной связью
Вещества с
ковалентной неполярной и слабополярной связьюВсе растворимые кислоты, основания (щёлочи) и соли
Все простые вещества, все оксиды и н/р кислоты, основания и соли.
Слайд 6
3. Задания к I-му положению ТЭД
Какие вещества называются
электролитами и неэлектролитами?
Назовите по два вещества, которые являются электролитами
и неэлектролитами.Укажите вид связи и принадлежность данных веществ к электролитам и неэлектролитам: KCl, O2 , HNO3 ,CuO.
Назовите из перечня веществ электролиты (не забудьте воспользоваться таблицей растворимости !): BaCl2 , CaO, H2 SO4 , NaOH, Cl2 , Zn(OH)2
Слайд 7
4. II-е положение ТЭД
В растворах электролиты диссоциируют
( распадаются
) на положительные и
отрицательные ионы.
Процесс распада электролита на ионы
называется
электролитическойдиссоциацией (ЭД).
Причиной диссоциации электролита является его взаимодействие с молекулами воды (гидратация).
Слайд 9
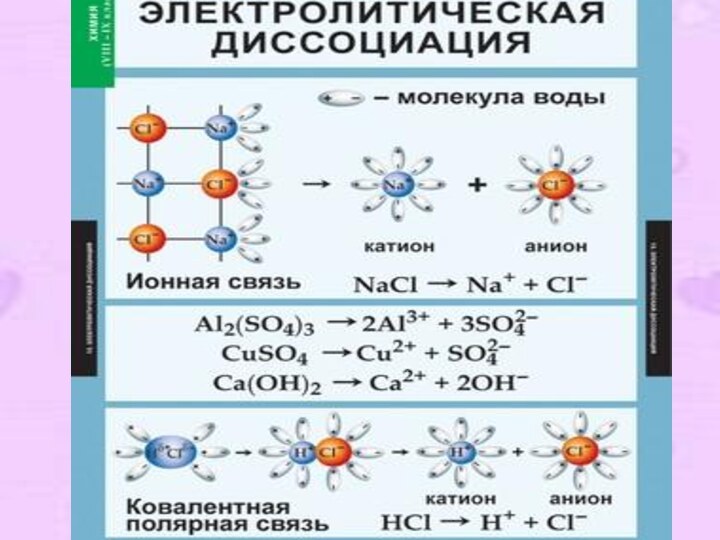
Механизм ЭД:
Вещества с ионной связью:
Ориентация
диполей воды
→
гидратация →
диссоциация.
Вещества с
ковалентной
связью:
Ориентация диполей
воды →гидратация→
ионизация→
диссоциация
Слайд 10
Типы ионов
По заряду: катионы (положительные) и анионы (отрицательные);
По
отношению к воде: Гидратированные и негидратированные ( в безводных
средах)По составу: простые и сложные.