и неорганическая химия.
Ахметов Н. С. Общая и неорганическая
химия. Чупахин А. П. Общая химия. Химическая связь и строение вещества.
Глинка Н.Л. Общая химия.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть




























![Строение атома Fe – [Ar] 3d64s2Fe2+ – [Ar]3d6Энергия необходимая для отрыва электрона называется энергия](/img/tmb/15/1460305/e48a3dfcd277ca3ffc455f57ebd043b4-720x.jpg)


Чупахин А. П. Общая химия. Химическая связь и строение вещества.
Глинка Н.Л. Общая химия.
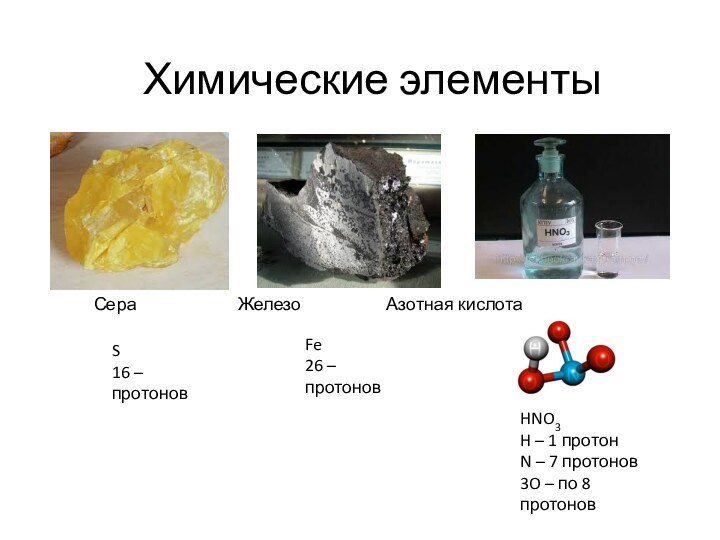
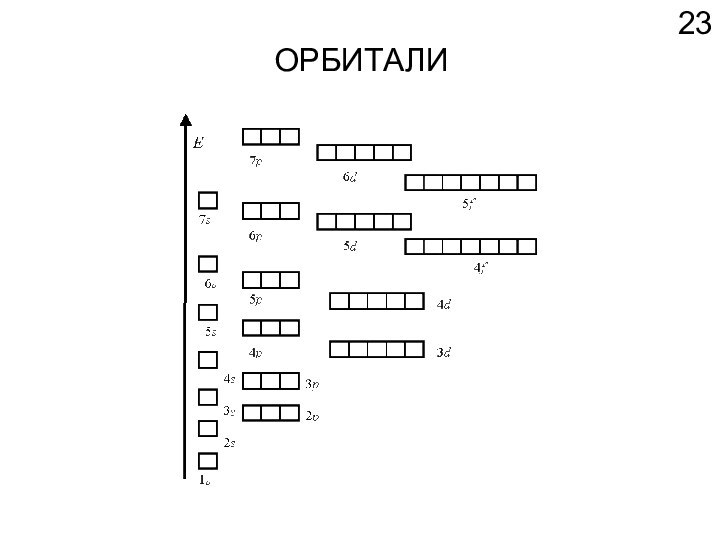
Химические элементы
+
+
+
-
-
-
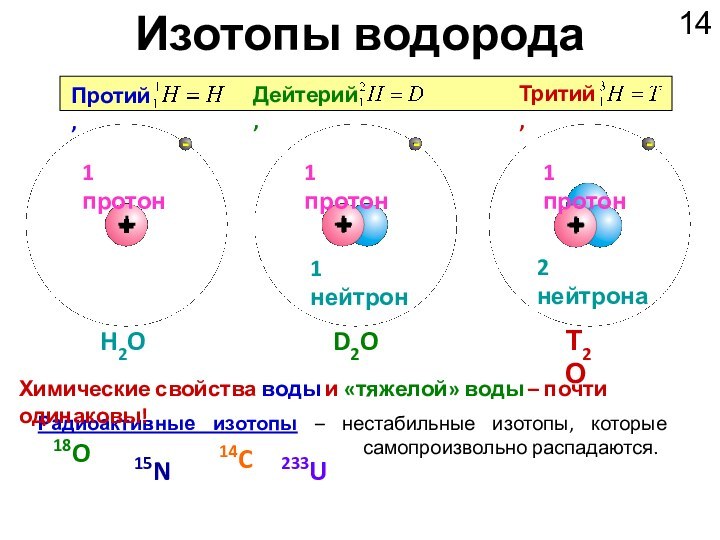
18O
15N
14C
233U
1 протон
1 протон
1 нейтрон
1 протон
2 нейтрона
U – Уран
Po – Полоний
Ru – Рутений
Ag – Серебро
Сера – S
Железо – Fe
Рубидий – Rb
Сурьма – As
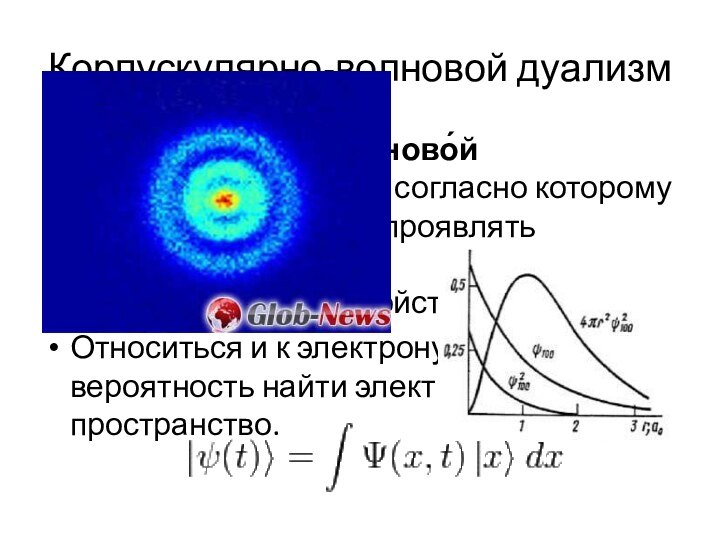
Одни электроны двигаются около ядра, а другие вдали от него.
Энергия взаимодействия с ядром - разная.
E = (k·q1·q2)/R2
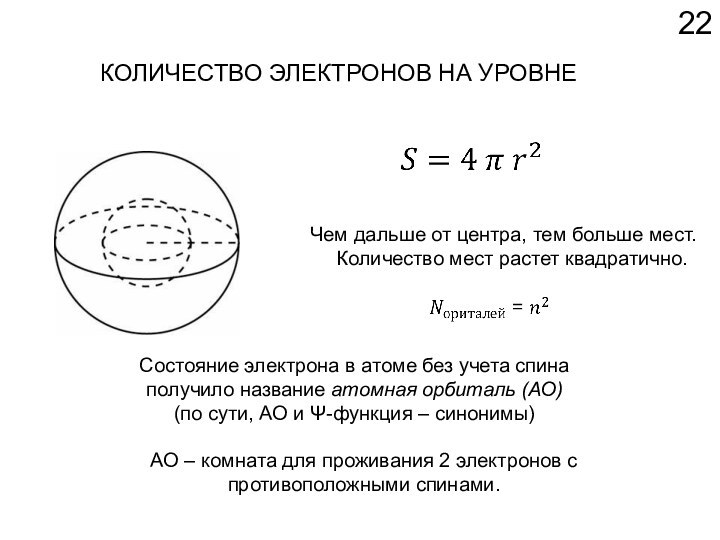
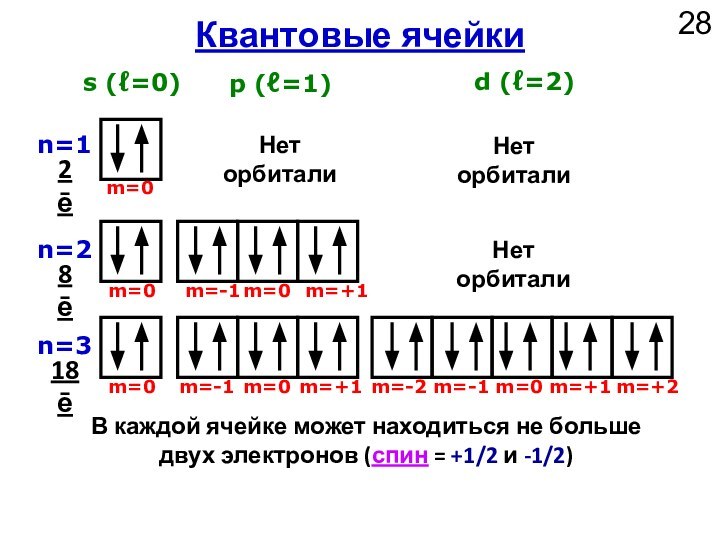
АО – комната для проживания 2 электронов с противоположными спинами.
-½ или +½
s
Спиновое
квантовое число
От -ℓ до +ℓ
m
Магнитное квантовое число
От 0 до n-1
ℓ
Орбитальное
квантовое число
От 1 до ∞
n
Главное
квантовое число
Принимаемые
значения
Обозначение
Орбитальное квантовое число ℓ:
1. Характеризует форму электронного облака
2. Указывает номер электронного подуровня
g
f
d
p
s
Обозначение
4
3
2
1
0
ℓ = 1 – это p подуровень
ℓ = 2 – это d подуровень
“Сфера”
“Гантелька”
“Переплетенные
гантельки”
Характеризует собственное движение электрона
Независимая характеристика электрона
-½
+½
Спин:
3 (f)
2 (d)
1 (p)
0 (s)
Орбитальное число ℓ
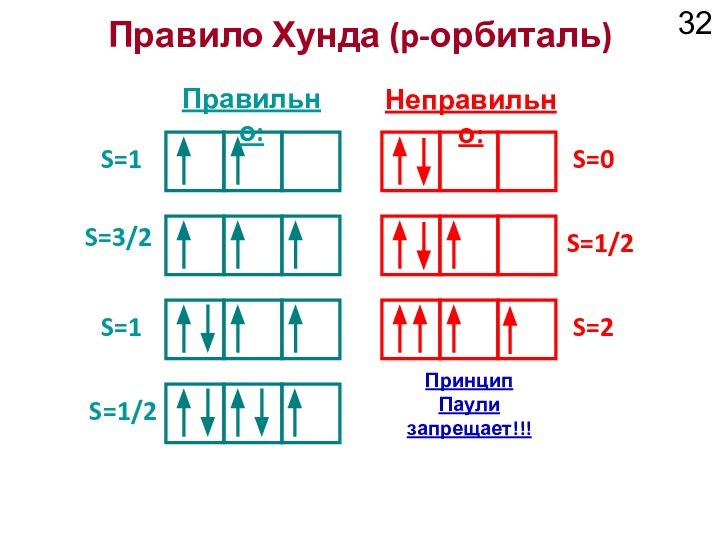
???
-2,-1,0,+1,+2
-1, 0, +1
0
Нет орбитали
Нет орбитали
Нет орбитали
2ē
8ē
18ē
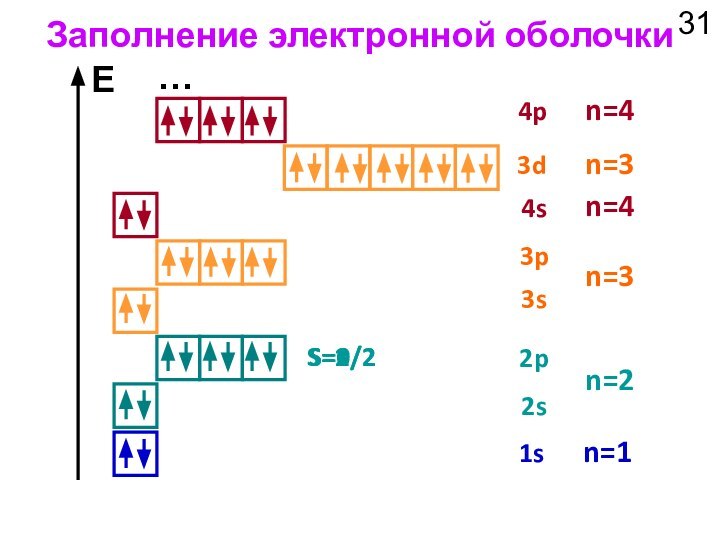
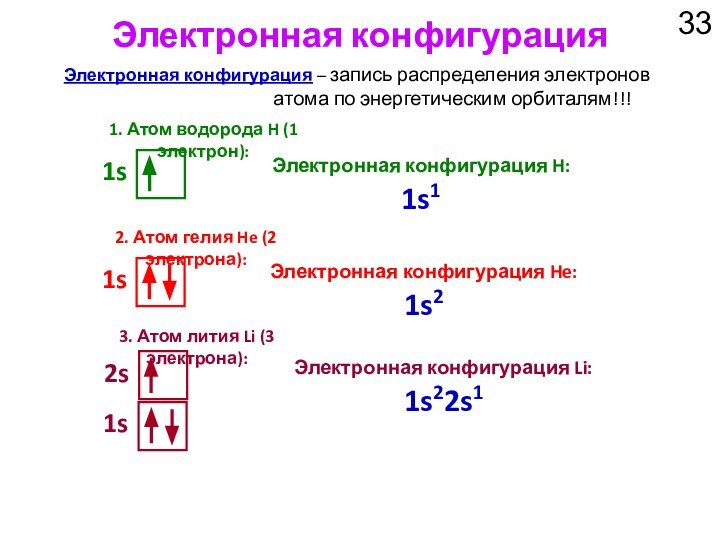
1s
Электронная конфигурация H: 1s1
Электронная конфигурация He: 1s2
3. Атом лития Li (3 электрона):
1s
Электронная конфигурация Li: 1s22s1
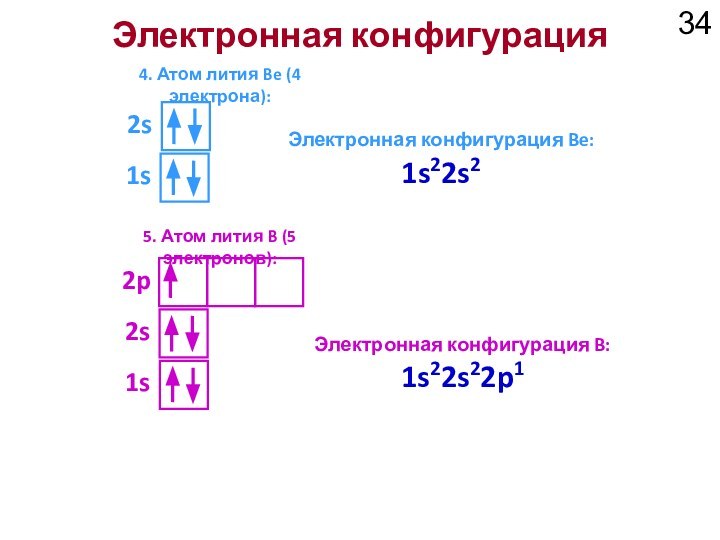
2s
2s
2p
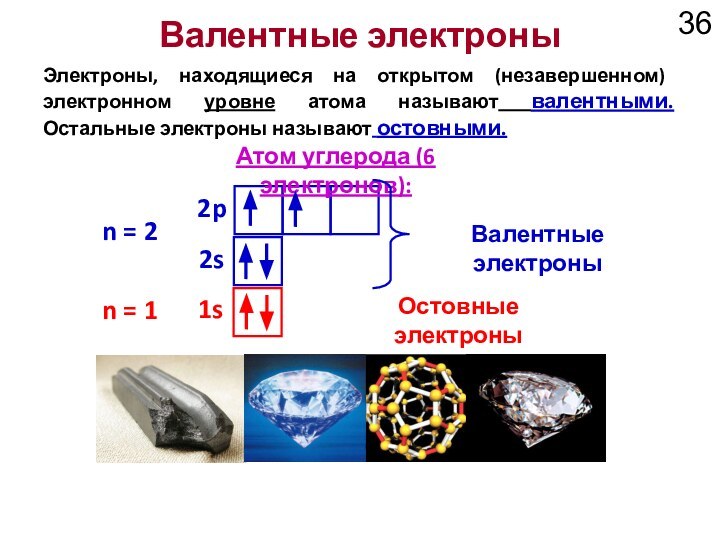
Валентные электроны
n = 1
n = 2
Остовные электроны
1s
2s
2p
n = 1
n = 2
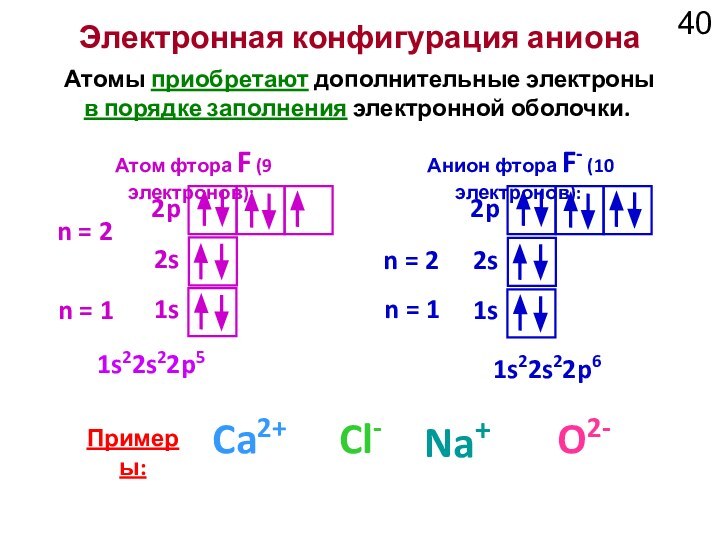
Анион фтора F- (10 электронов):
Примеры:
Na+
O2-
Ca2+
Cl-
1s22s22p5
1s22s22p6
1s
n = 1
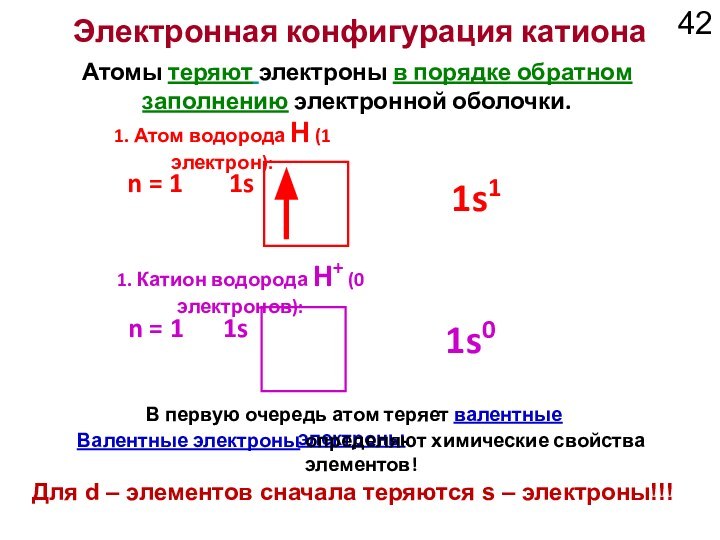
1. Атом водорода H (1 электрон):
1s
n = 1
1. Катион водорода H+ (0 электронов):
1s1
1s0
Валентные электроны определяют химические свойства элементов!
Для d – элементов сначала теряются s – электроны!!!
O
O2-
Na
Na+
10 электронов
10 электронов
=
+2é
-1é
Частицы O2- и Na+ - изоэлектронны друг другу!!!
1s22s22p4
1s22s22p6
1s22s22p63s1
1s22s22p6