- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Щелочные металлы
Содержание
- 2. Цель: повторить свойства металлов, систематизировать и углубить
- 3. Строение и свойства атомов
- 4. Щелочные металлы — это элементы главной подгруппы
- 6. На внешнем энергетическом уровне атомы этих элементов
- 7. Щелочные металлы - простые вещества
- 8. Серебристо-белые мягкие вещества (режутся ножом), с характерным
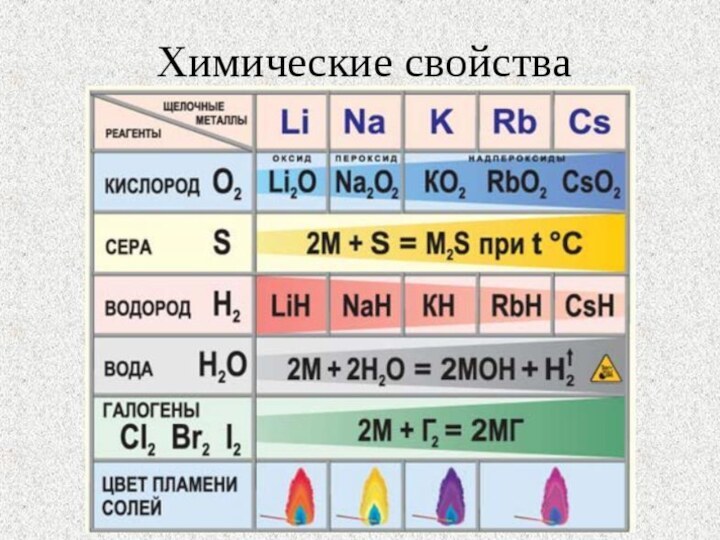
- 10. Химические свойства
- 11. Все щелочные металлы чрезвычайно активны, во всех
- 13. Взаимодействие с неметаллами
- 14. Щелочные металлы легко реагируют с кислородом, но
- 15. Взаимодействие с водородом, серой, фосфором, углеродом, кремнием
- 16. С азотом легко реагирует только литий, реакция
- 17. Взаимодействие с водой
- 18. Все щелочные металлы реагируют с водой, литий
- 19. Щелочные металлы способны реагировать с разбавленными кислотами
- 20. Соединения щелочных металловВ свободном виде в природе
- 21. Гидроксид натрия NаОН в технике известен под
- 22. Соли щелочных металлов — твердые кристаллические вещества
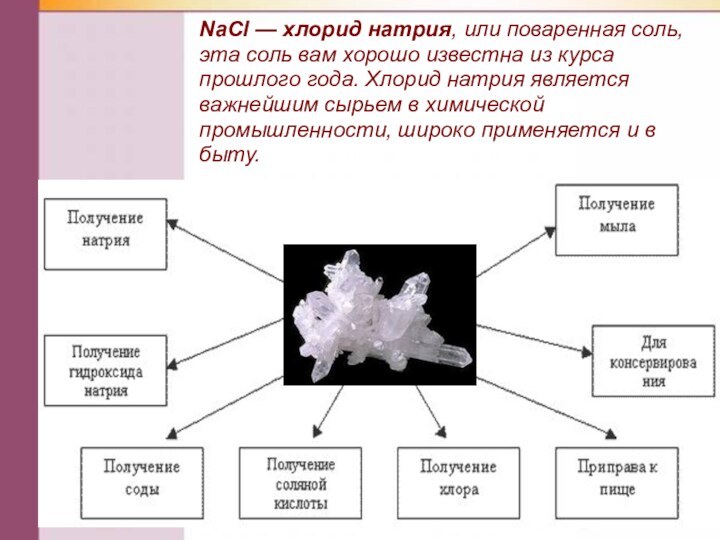
- 24. NаСl — хлорид натрия, или поваренная соль,
- 25. Скачать презентацию
- 26. Похожие презентации
Цель: повторить свойства металлов, систематизировать и углубить знания о щелочных металлах на основании их сравнительной характеристики. Сформировать понятие о физических и химических свойствах щелочных металлов.




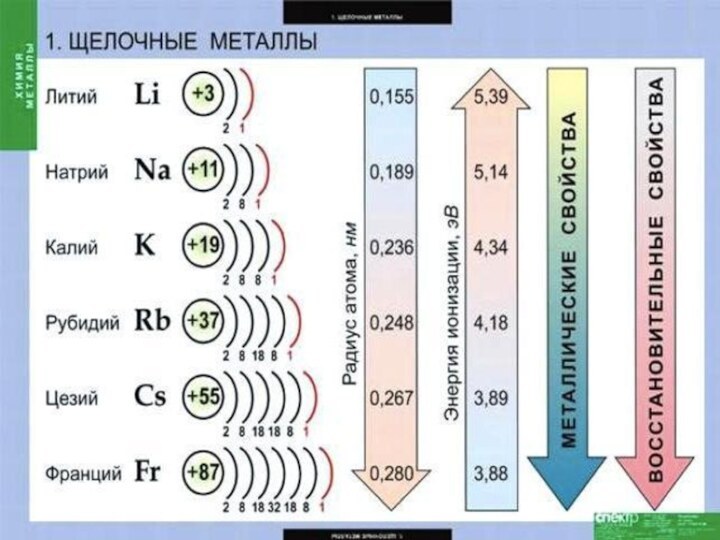

















Слайд 4 Щелочные металлы — это элементы главной подгруппы I
группы :
литий Li,
натрий
Nа,калий К,
рубидий Rb,
цезий Сs ,
франций Fr.
Слайд 6 На внешнем энергетическом уровне атомы этих элементов содержат
по одному электрону, находящемуся на сравнительно большом удалении от
ядра. Они легко отдают этот электрон, поэтому являются очень сильными восстановителями. Во всех своих соединениях щелочные металлы проявляют степень окисления +1. Восстановительные свойства их усиливаются при переходе от Li к Сs, что связано с ростом радиусов их атомов. Это наиболее типичные представители металлов: металлические свойства выражены у них особенно ярко.Слайд 8 Серебристо-белые мягкие вещества (режутся ножом), с характерным блеском
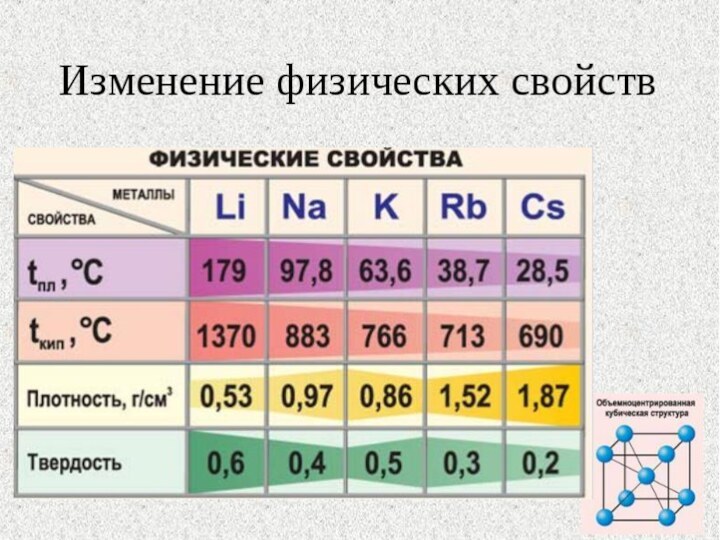
на свежесрезанной поверхности. Все они легкие и легкоплавкие, причем,
как правило, плотность их возрастает от Li к Сs, а температура плавления, наоборот, уменьшается.Слайд 11 Все щелочные металлы чрезвычайно активны, во всех химических
реакциях проявляют восстановительные свойства, отдают свой единственный валентный электрон,
превращаясь в положительно заряженный катион.В качестве окислителей могут выступать простые вещества – неметаллы, оксиды, кислоты, соли, органические вещества.
Слайд 14 Щелочные металлы легко реагируют с кислородом, но каждый
металл проявляет свою индивидуальность:
оксид образует только литий:
4Li + O2
= 2Li2O,натрий образует пероксид:
2Na + O2 = Na2O2,
калий, рубидий и цезий – надпероксид:
K + O2 = KO2.
Слайд 15 Взаимодействие с водородом, серой, фосфором, углеродом, кремнием протекает
при нагревании:
с водородом образуются гидриды:
2Na + H2 = 2NaH,
с
серой – сульфиды:2K + S = K2S,
с фосфором – фосфиды:
3K + P = K3P,
с кремнием – силициды:
4Cs + Si = Cs4Si,
с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2
Слайд 16 С азотом легко реагирует только литий, реакция протекает
при комнатной температуре с образованием нитрида лития:
6Li + N2
= 2Li3N.С галогенами все щелочные металлы образуют галогениды:
2Na + Cl2 = 2NaCl.
Слайд 18 Все щелочные металлы реагируют с водой, литий реагирует
спокойно, держась на поверхности воды, натрий часто воспламеняется, а
калий, рубидий и цезий реагируют со взрывом:Слайд 19 Щелочные металлы способны реагировать с разбавленными кислотами с
выделением водорода, однако реакция будет протекать неоднозначно, поскольку металл
будет реагировать и с водой, а затем образующаяся щелочь будет нейтрализоваться кислотой.При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Взаимодействие щелочных металлов с кислотами практически всегда сопровождается взрывом, и такие реакции на практике не проводятся.
Взаимодействие с кислотами
Слайд 20
Соединения щелочных металлов
В свободном виде в природе щелочные
металлы не встречаются из-за своей исключительно высокой химической активности.
Некоторые их природные соединения, в частности соли натрия и калия, довольно широко распространены, они содержатся во многих минералах, растениях, природных водах.Слайд 21 Гидроксид натрия NаОН в технике известен под названиями
едкий натр, каустическая сода, каустик.
Техническое название гидроксида калия
КОН — едкое кали.Оба гидроксида — NaОН и КОН разъедают ткани и бумагу, поэтому их называют также едкими щелочами.
Едкий натр применяется в больших количествах для очистки нефтепродуктов, в бумажной и текстильной промышленности, для производства мыла и волокон.
Едкое кали дороже и применяется реже. Основная область его применения — производство жидкого мыла.
Слайд 22 Соли щелочных металлов — твердые кристаллические вещества ионного
строения.
.
Nа2СO3 — карбонат натрия, образует кристаллогидрат Nа2СO3* 10Н2O, известный
под названием кристаллическая сода, которая применяется в производстве стекла, бумаги, мыла. Вам в быту более известна кислая соль — гидрокарбонат натрия NаНСO3, она применяется в пищевой промышленности (пищевая сода) и в медицине (питьевая сода).
К2С03 — карбонат калия, техническое название — поташ, используется в производстве жидкого мыла.
Nа2SO4 • 10Н2O — кристаллогидратат сульфата натрия, техническое название — глауберова соль, применяется для производства соды и стекла и в качестве слабительного средства.