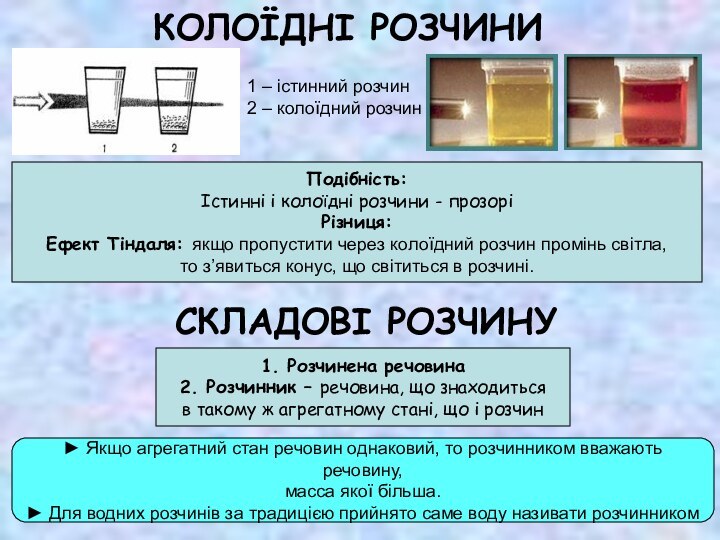
Ефект Тіндаля: якщо пропустити через колоїдний розчин промінь світла,
то з’явиться конус, що світиться в розчині.
1 – істинний розчин
2 – колоїдний розчин
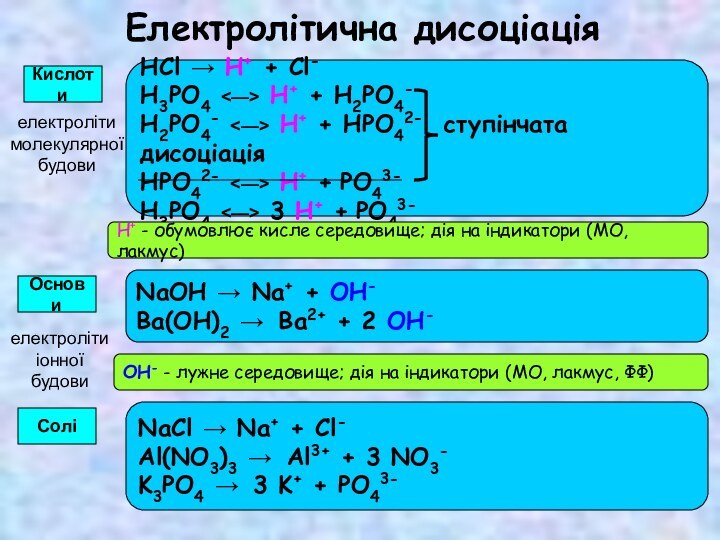
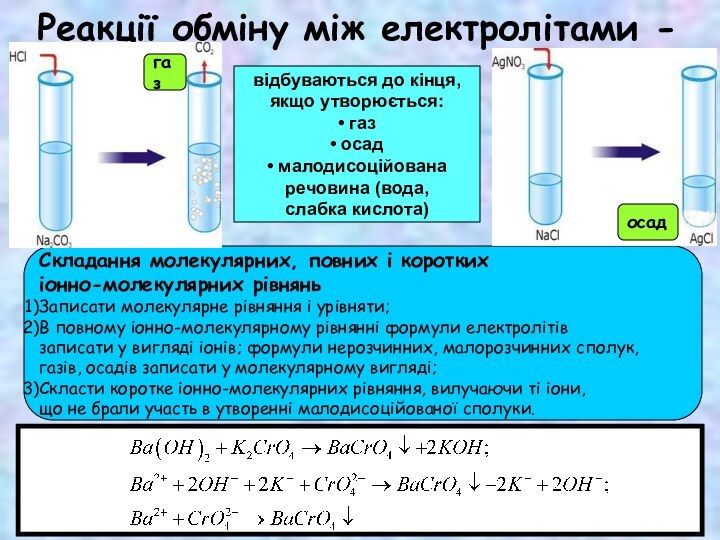
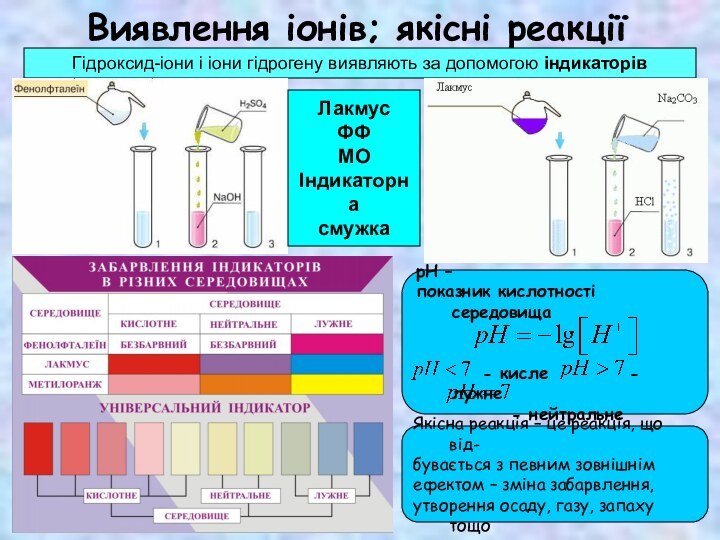
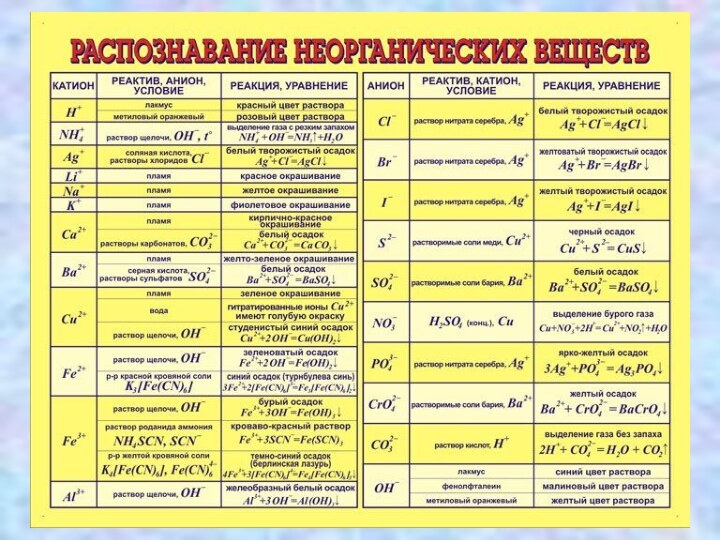
СКЛАДОВІ РОЗЧИНУ
1. Розчинена речовина
2. Розчинник – речовина, що знаходиться
в такому ж агрегатному стані, що і розчин
► Якщо агрегатний стан речовин однаковий, то розчинником вважають речовину,
масса якої більша.
► Для водних розчинів за традицією прийнято саме воду називати розчинником