- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Реакции окисления и восстановления органических соединений
Содержание
- 2. Реакции окисления-восстановления реакции, в ходе которых
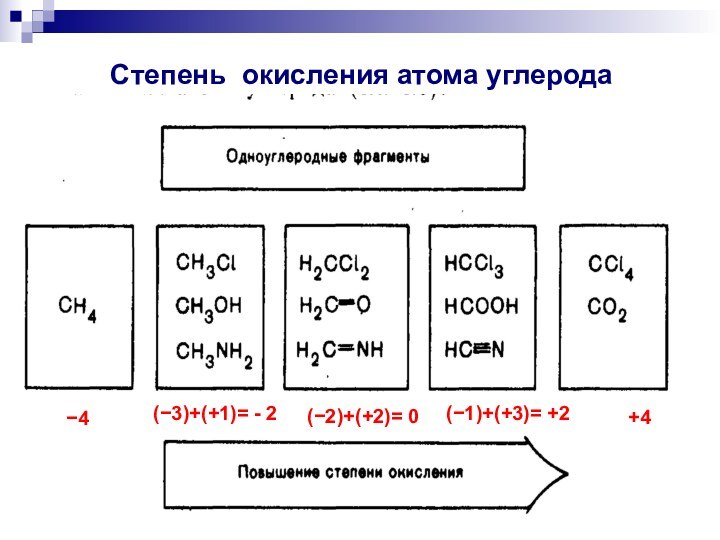
- 3. 4(3)+(+1)= - 2(2)+(+2)= 0(1)+(+3)= +2+4 Степень окисления атома углерода
- 5. Восстановление замена
- 6. Окисление органического соединения протекает тем
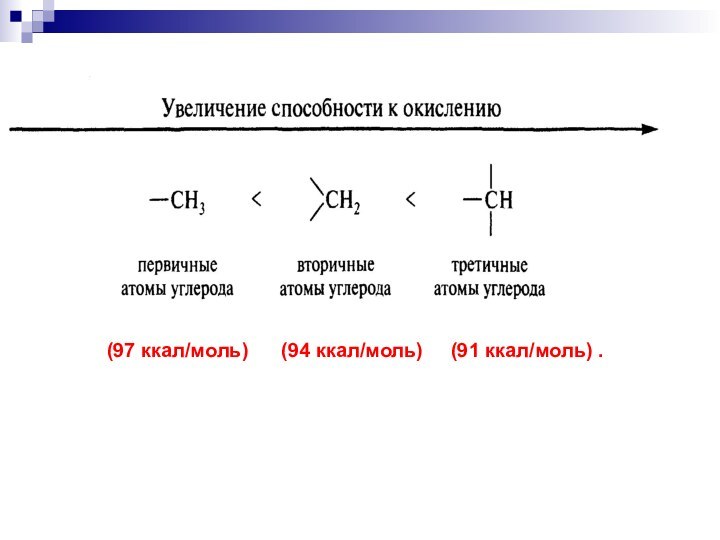
- 7. (97 ккал/моль) (94 ккал/моль) (91 ккал/моль) .
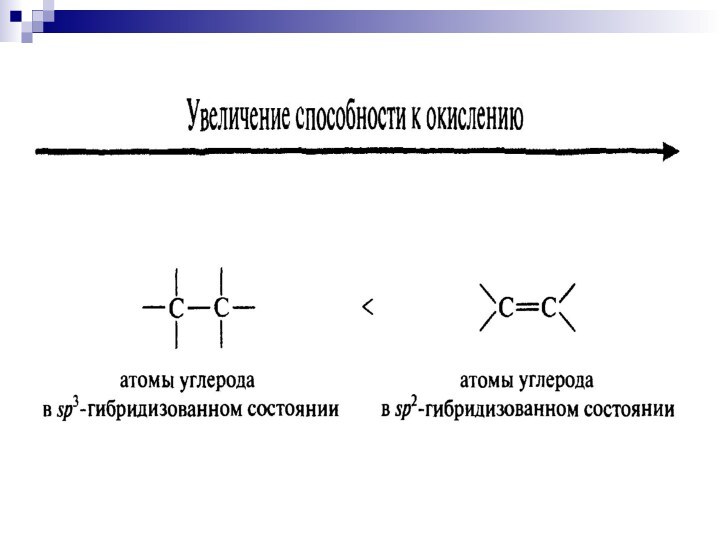
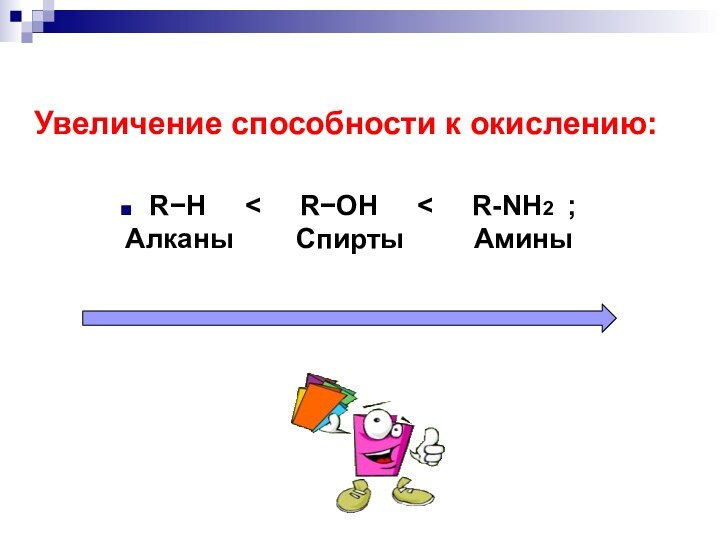
- 9. Увеличение способности к окислению:RH <
- 10. Горение алканов
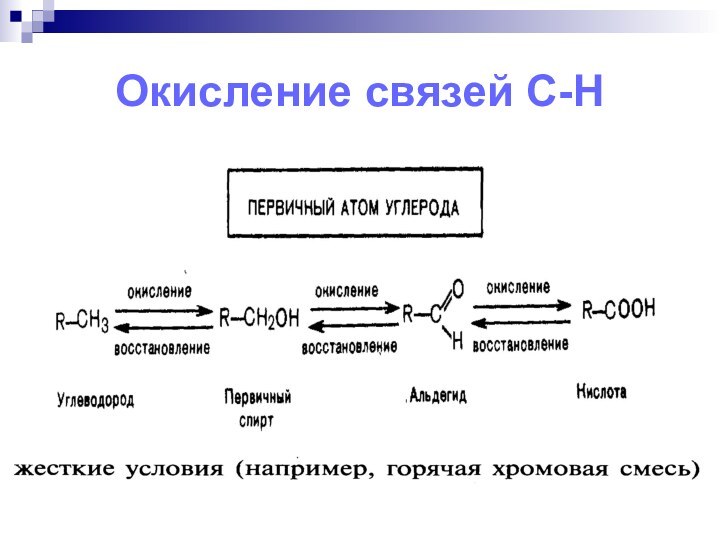
- 11. Окисление связей С-Н
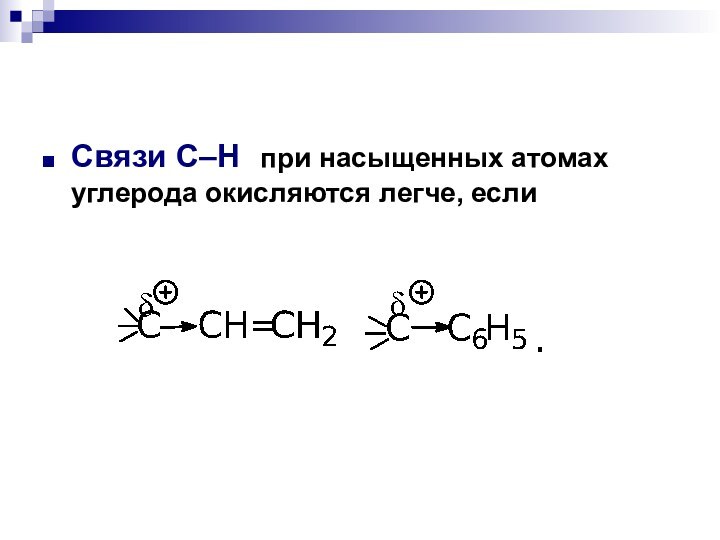
- 14. Связи С–Н при насыщенных атомах углерода окисляются легче, если
- 15. Окисление в мягких условиях ( в условиях организма) :
- 16. Ферментативное гидроксилирование соединений со связью С-НКофермент- восстанавливающий агент
- 17. Коферменты: функции Вспомогательные органические соединения
- 18. озонолиз эпоксидирование гидроксилирование озон надкислоты Окисление двойных углерод-углеродных связейперманганат калия в слабощелочной средеМягкое окисление
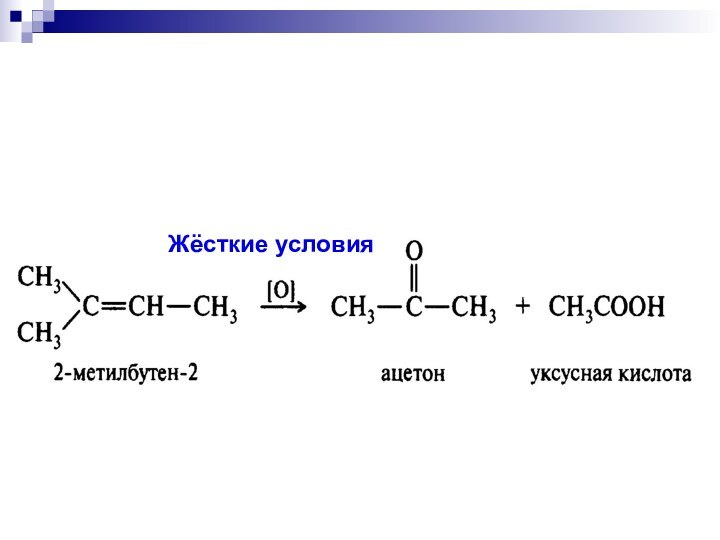
- 19. Жёсткие условия
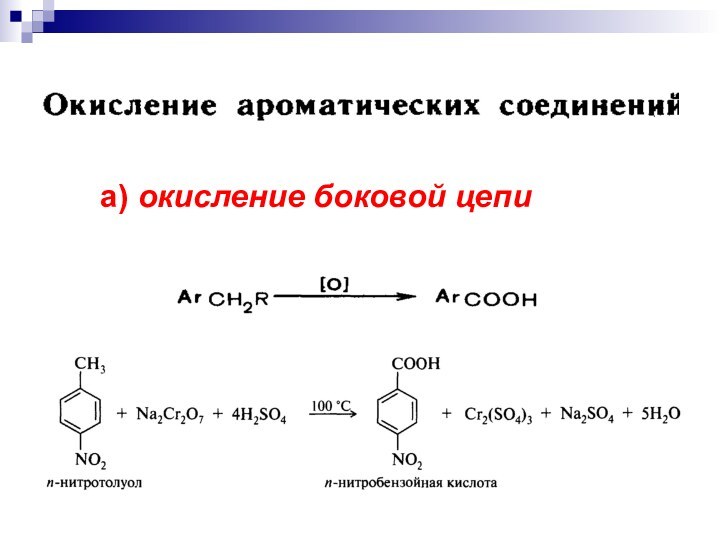
- 20. а) окисление боковой цепи
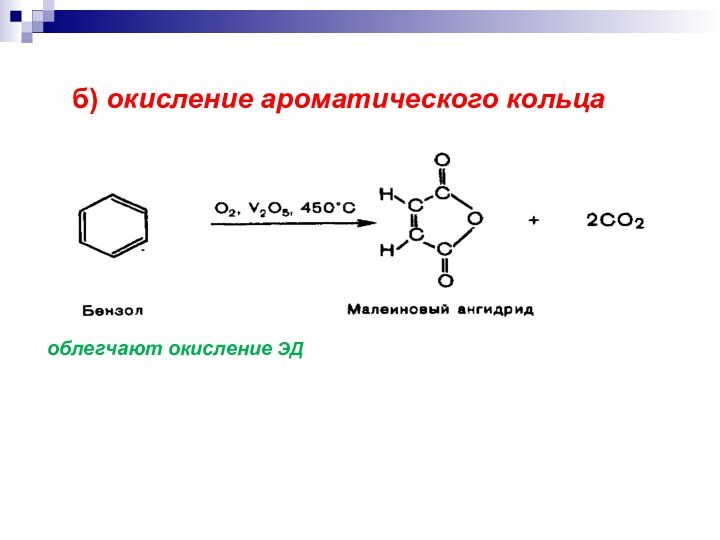
- 21. б) окисление ароматического кольца облегчают окисление ЭД
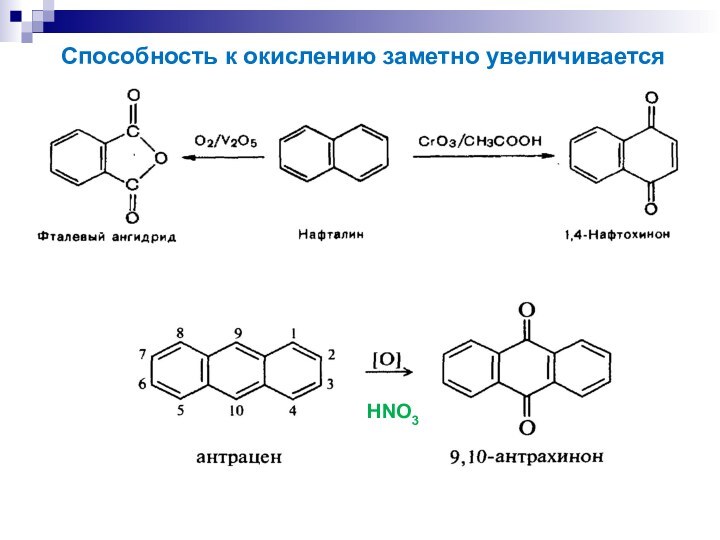
- 22. HNO3Способность к окислению заметно увеличивается
- 24. (причина канцерогенности многоядерных аренов) Полиядерные арены способны окисляться и до эпоксидов:
- 25. Окисление спиртов (получение
- 26. Дегидрирование спиртов над металлическим катализатором
- 27. Биологическое дегидрированиеокисленная форма восстановленная формаПеренос Н-спиртальдегид
- 28. Никотинамидадениндинуклеотид
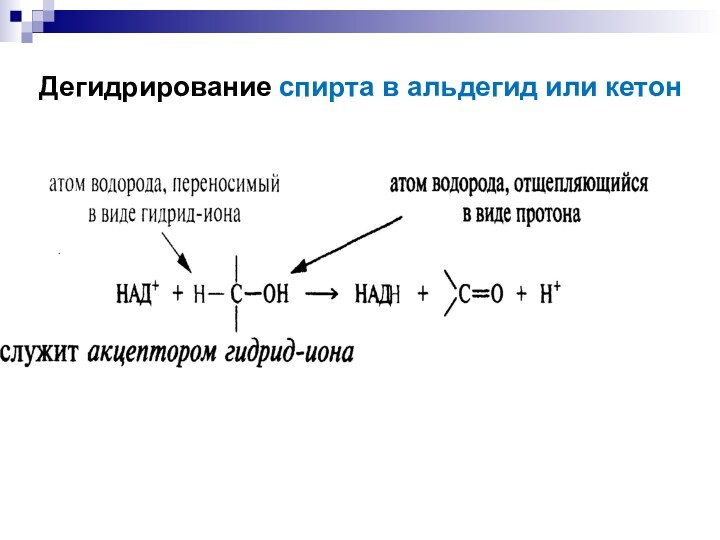
- 29. Дегидрирование спирта в альдегид или кетон
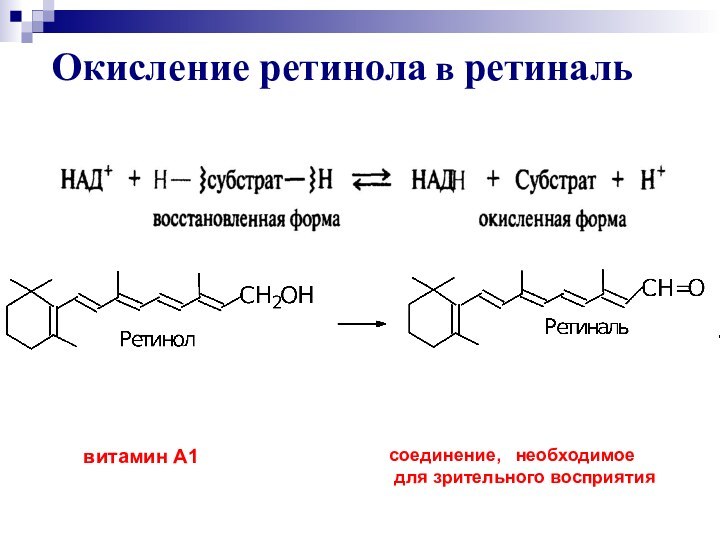
- 30. Окисление ретинола в ретинальвитамин А1 соединение, необходимое для зрительного восприятия
- 31. Акцептор 2 атомов Н
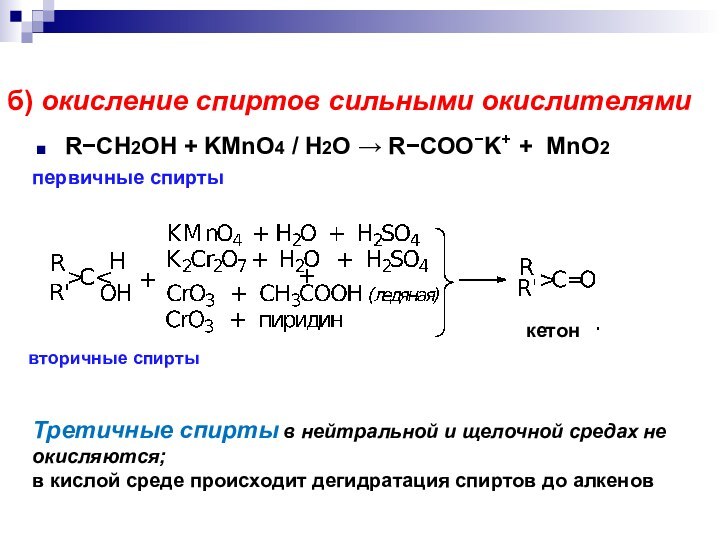
- 32. б) окисление спиртов сильными окислителями RCH2OH +
- 33. Окисление альдегидов RCH=O + [Ag(NH3)2]OH
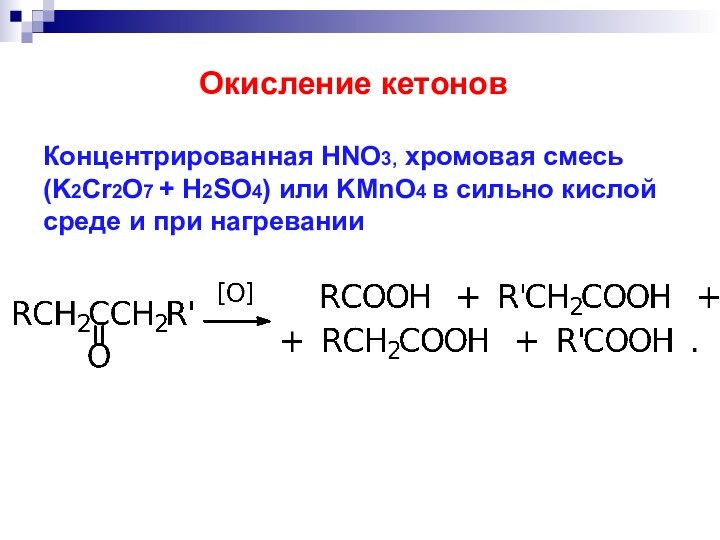
- 34. Концентрированная HNO3, хромовая смесь (K2Cr2O7 + H2SO4)
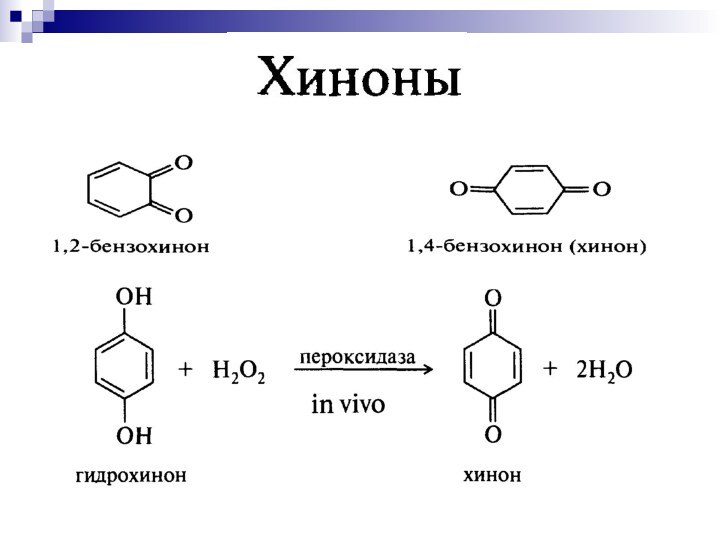
- 35. до двухатомных фенолов:ГидрохинонОкисление фенолов [O]
- 36. хиноны Хиноны - стимуляторы роста, антибиотики, процесс дыхания.
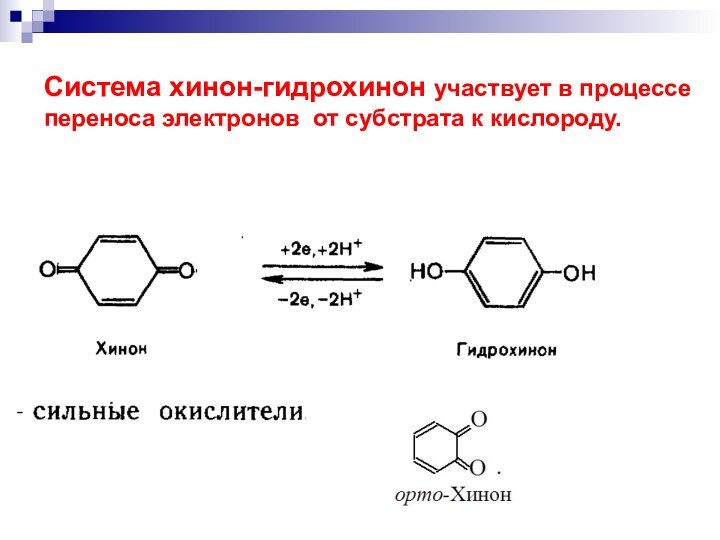
- 37. Система хинон-гидрохинон участвует в процессе переноса электронов от субстрата к кислороду.
- 38. RSH + H2O2, или CuCl2, или O2 RSSR .Тиолы Мягкое окисление
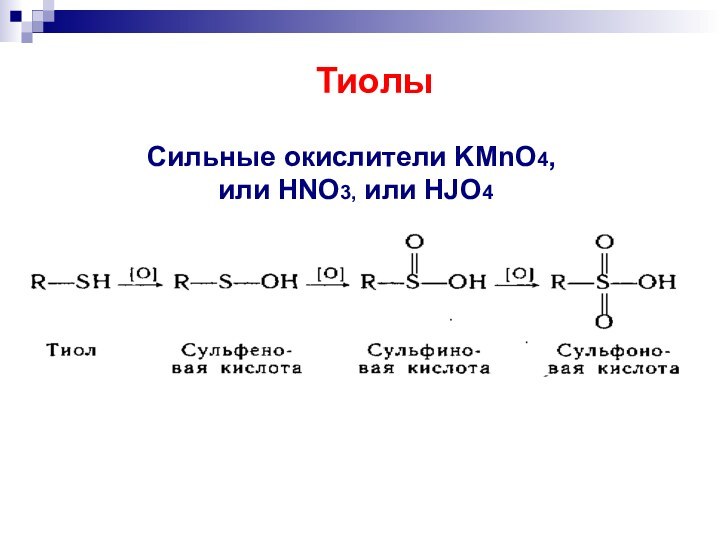
- 39. Сильные окислители KMnO4, или HNO3, или HJO4 Тиолы
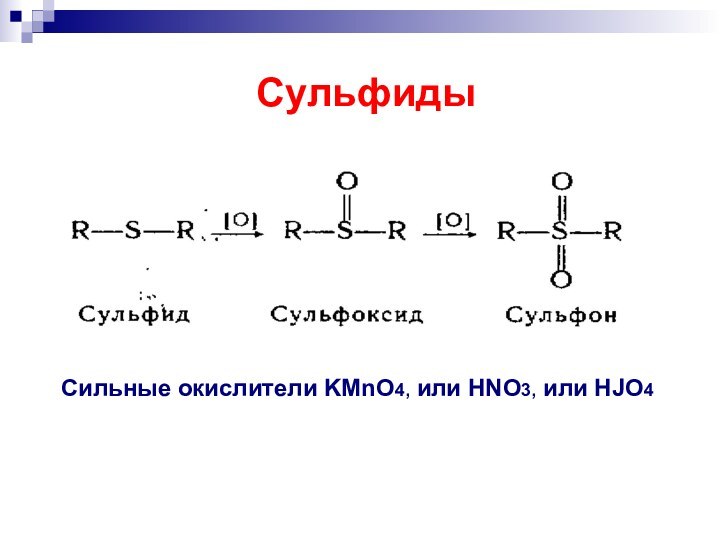
- 40. Сильные окислители KMnO4, или HNO3, или HJO4 Сульфиды
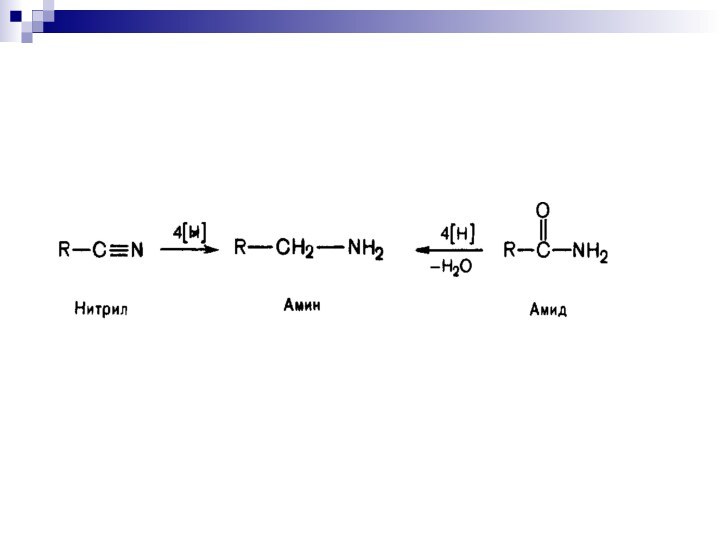
- 41. Окисление аминов
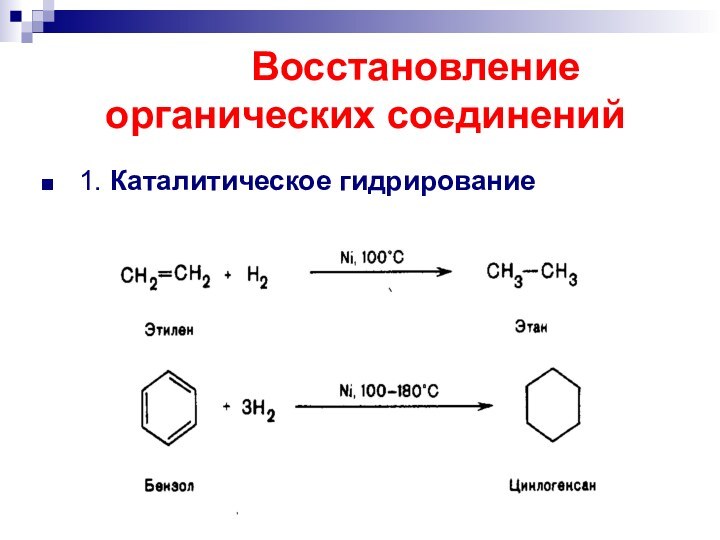
- 42. Восстановление органических соединений 1. Каталитическое гидрирование
- 43. Каталитическое гидрирование Цис- присоединение
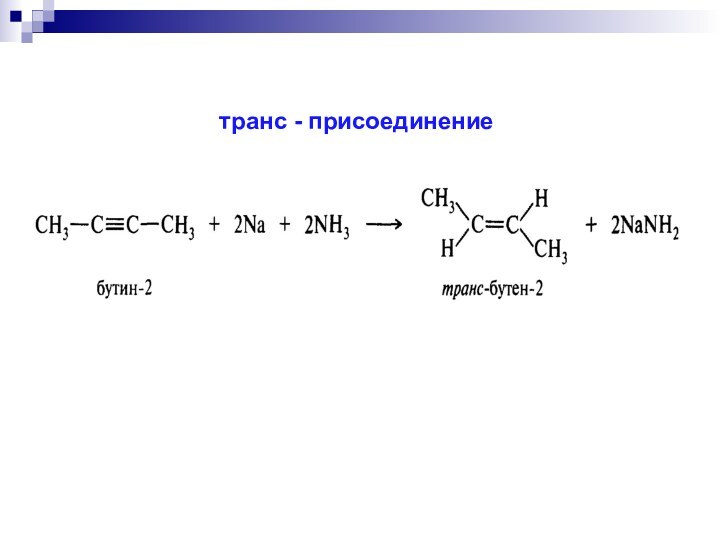
- 44. транс - присоединение
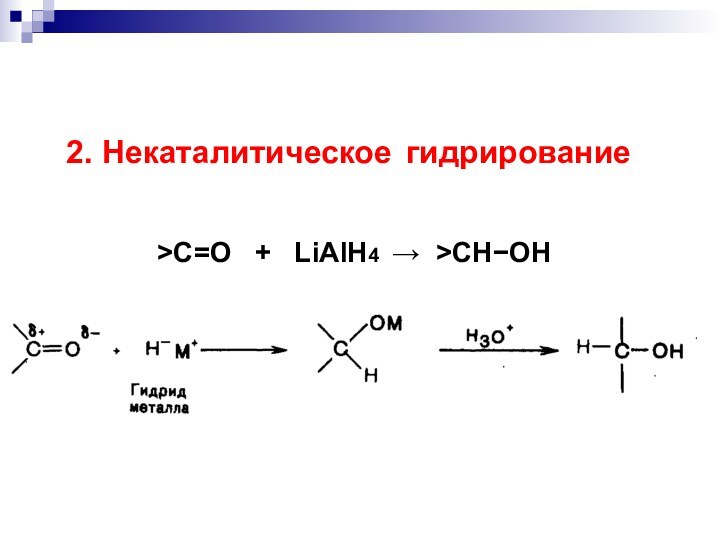
- 45. 2. Некаталитическое гидрирование >C=O + LiAlH4 >CHOH
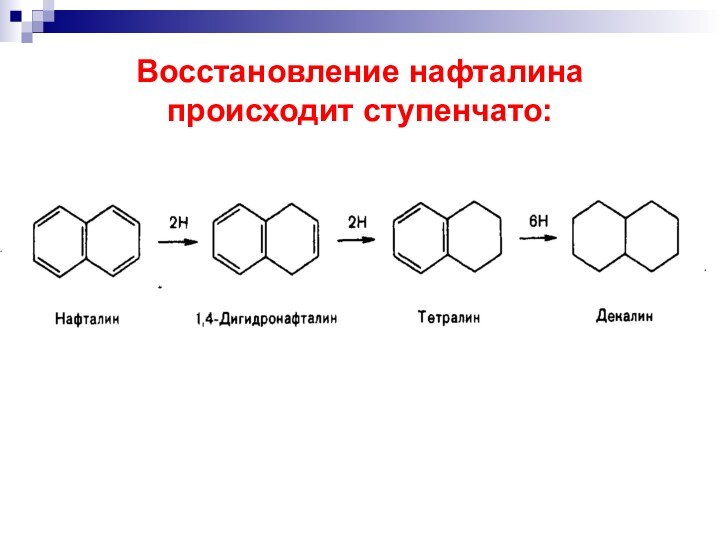
- 46. Восстановление нафталина происходит ступенчато:
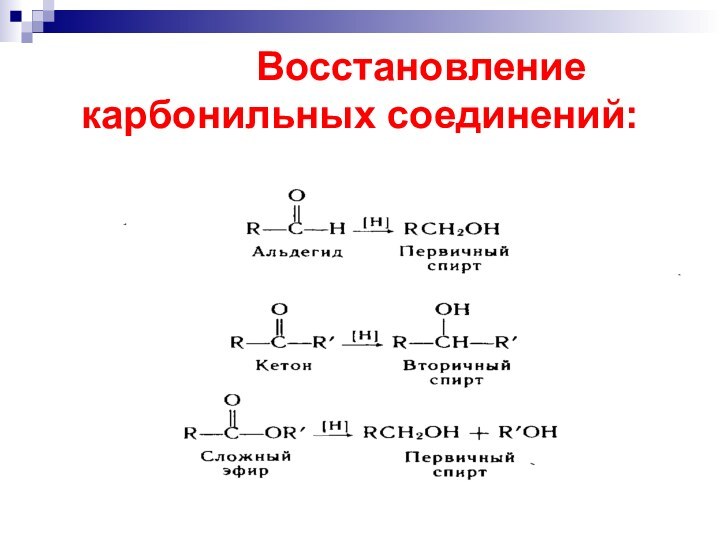
- 47. Восстановление карбонильных соединений:
- 49. 3. Биохимическое восстановление>C=O
- 50. Никотинамидадениндинуклеотидкофермент, присутствующий во всех живых клетках; входит
- 51. ОТТО ГЕНРИХ
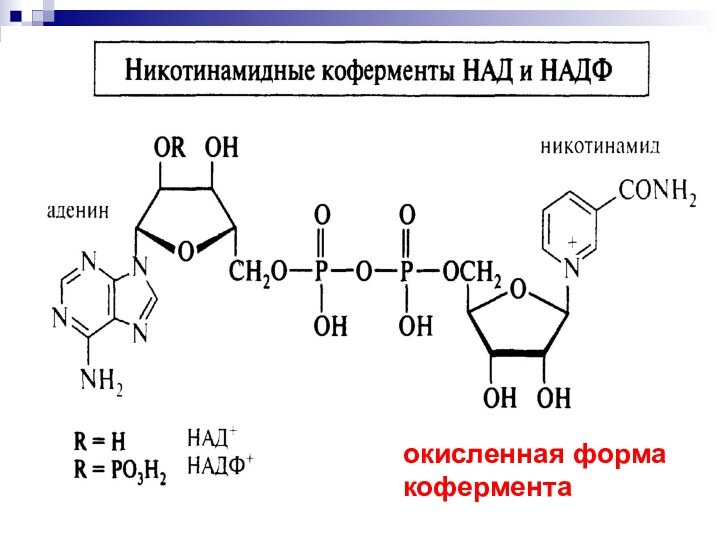
- 52. окисленная форма кофермента
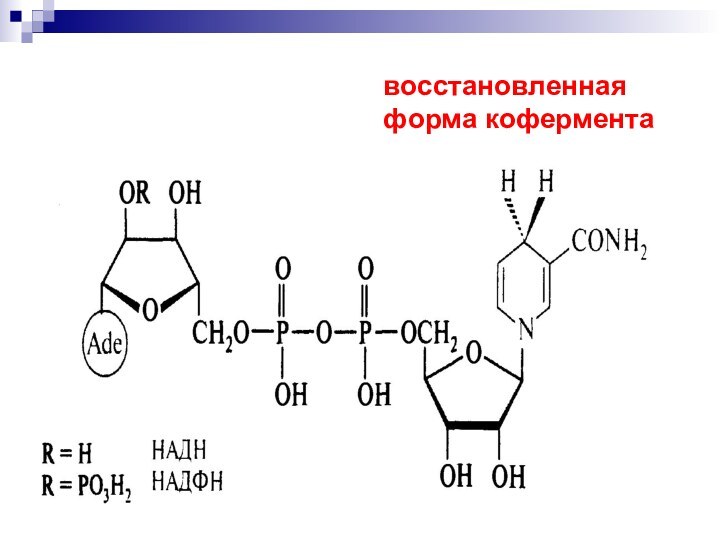
- 53. восстановленная форма кофермента
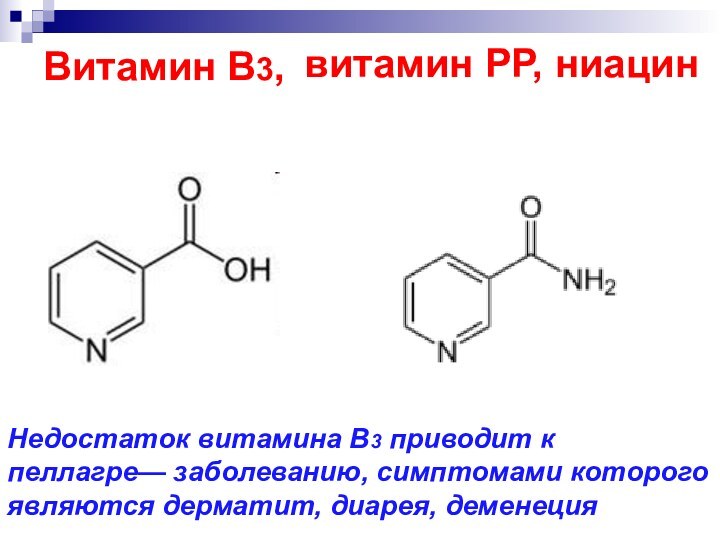
- 54. Витамин В3, витамин РР, ниацин Недостаток витамина
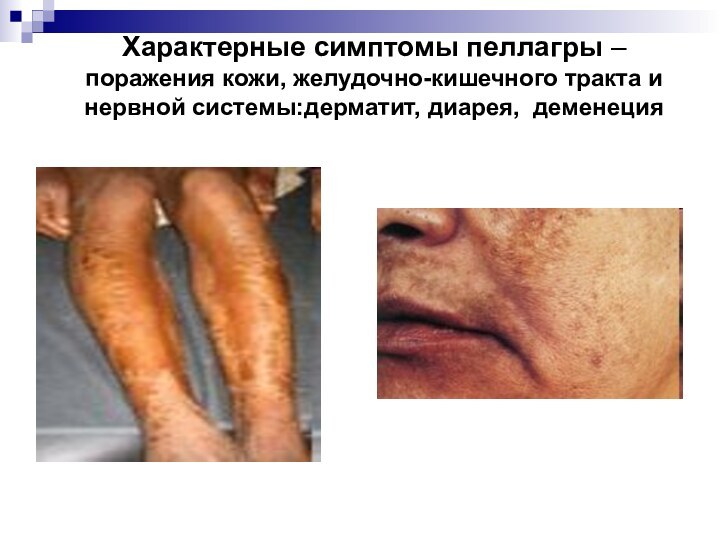
- 55. Характерные симптомы пеллагры – поражения кожи, желудочно-кишечного тракта и нервной системы:дерматит, диарея, деменеция
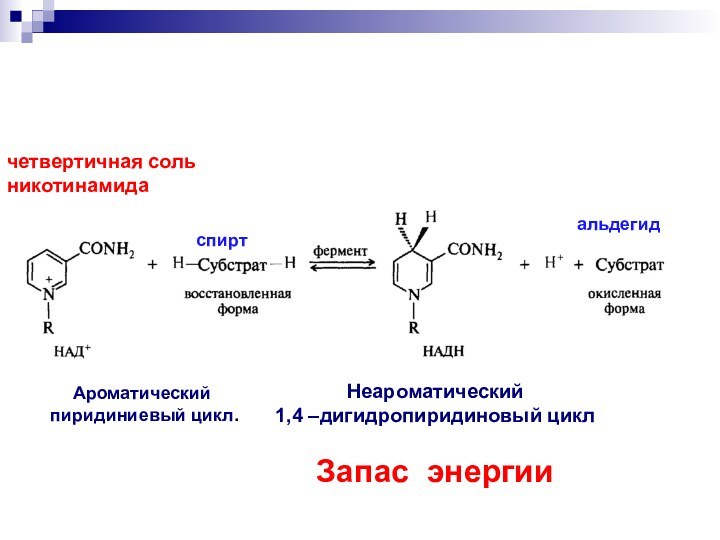
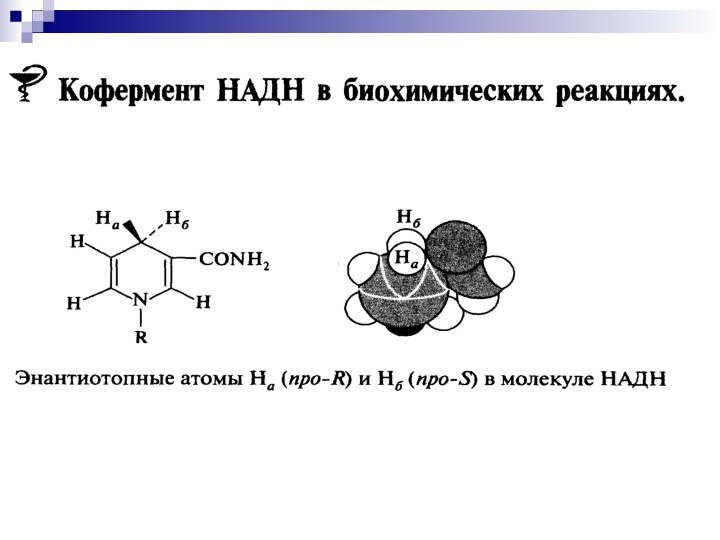
- 56. Ароматический пиридиниевый цикл.Неароматический 1,4 –дигидропиридиновый циклЗапас энергиичетвертичная соль никотинамидаспиртальдегид
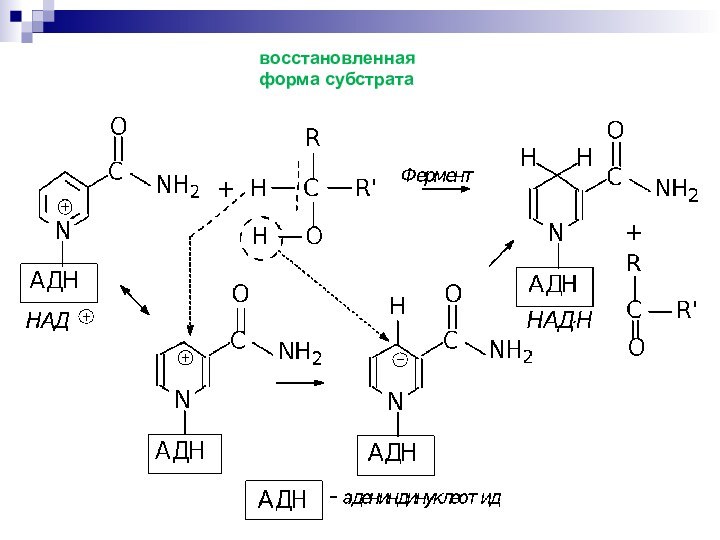
- 57. восстановленная форма субстрата
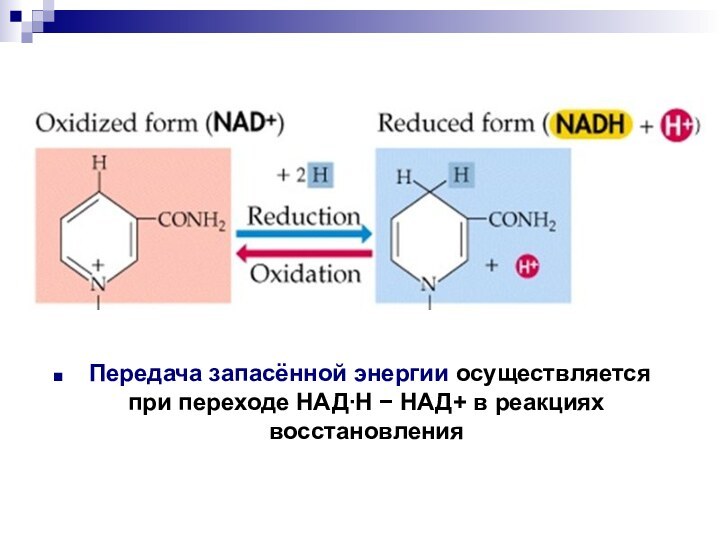
- 58. Передача запасённой энергии осуществляется при переходе НАДН НАД+ в реакциях восстановления
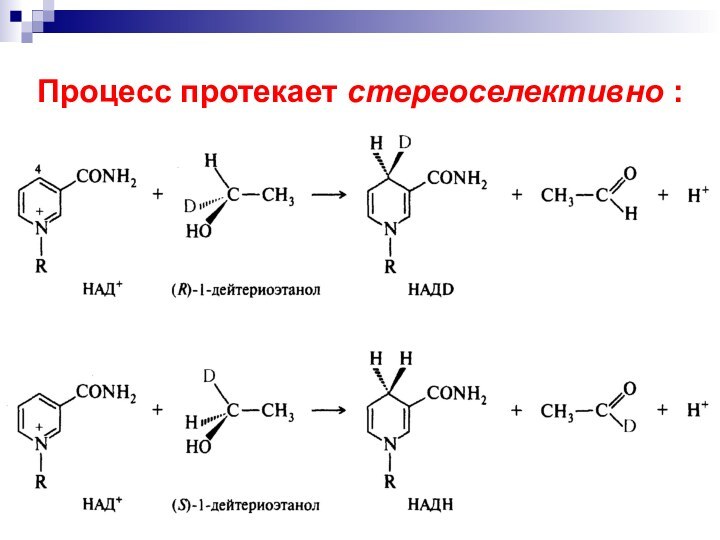
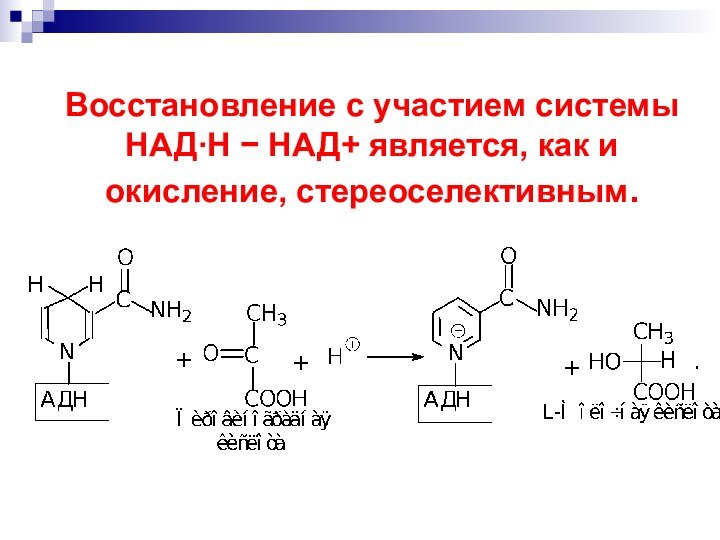
- 60. Процесс протекает стереоселективно :
- 62. Восстановление с участием системы НАДН НАД+ является, как и окисление, стереоселективным.
- 64. Флавинадениндинуклеотид Небелковый кофермент большинства ферментов-флавопротеидов, присутствующих во
- 65. Флавинадениндинуклеотид.
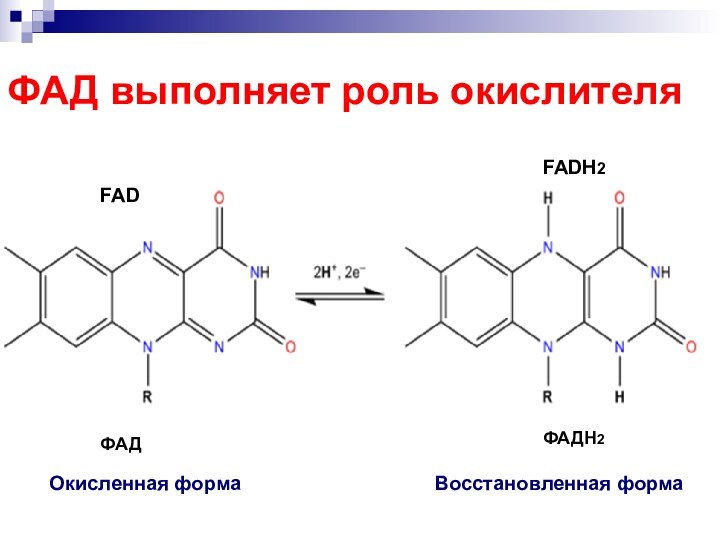
- 66. ФАД выполняет роль окислителяFAD FADH2 ФАД ФАДН2 Окисленная форма Восстановленная форма
- 68. Источники:дрожжи, листовые зелёные овощи,
- 69. Последствия
- 70. Система переноса электронов с помощью гидрид-ионов
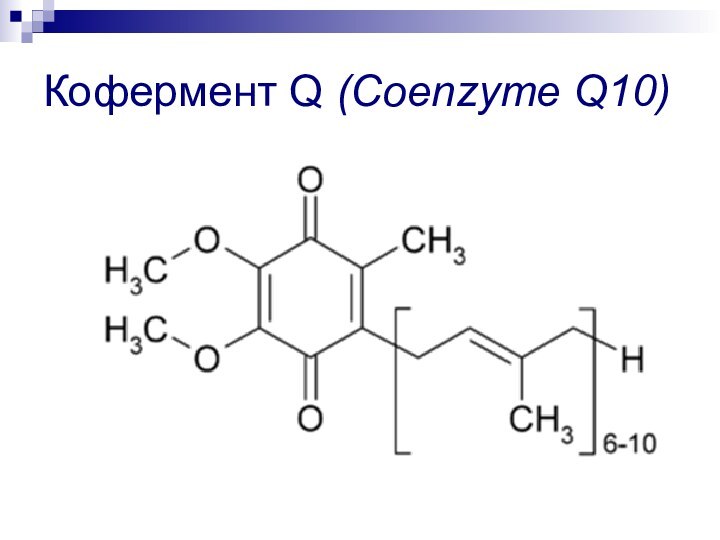
- 71. Кофермент Q (Coenzyme Q10)
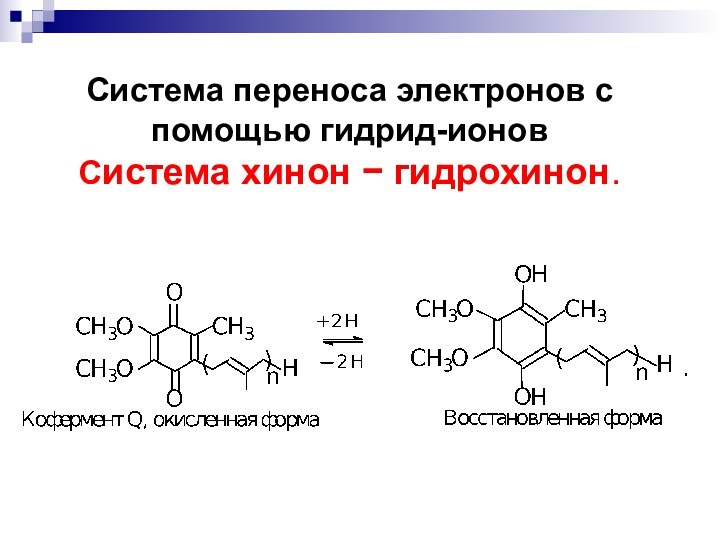
- 72. Система переноса электронов с помощью гидрид-ионов Система хинон гидрохинон.
- 73. Функции в организме:*Обеспечивает выработку энергии
- 74. Богатые источники CoQ10говяжье сердце и другие внутренние
- 76. Скачать презентацию
- 77. Похожие презентации











![Реакции окисления и восстановления органических соединений Окисление альдегидов RCH=O + [Ag(NH3)2]OH RCOONH4](/img/tmb/12/1176181/5441b87ef9627b0d1aef8d77a00c0cc4-720x.jpg)
![Реакции окисления и восстановления органических соединений до двухатомных фенолов:ГидрохинонОкисление фенолов [O]](/img/tmb/12/1176181/d00bf92d33aa8be5999cce236873452d-720x.jpg)















Слайд 2
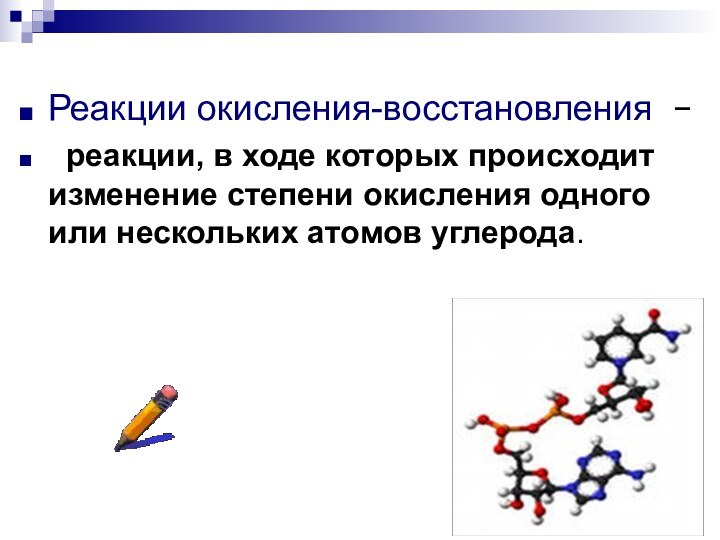
Реакции окисления-восстановления
реакции, в ходе которых происходит
изменение степени окисления одного или нескольких атомов углерода.
Слайд 4
Окисление
Процесс удаления водорода
образование кратной связи или
замена
связей СН на связи с другими более ЭО элементами(степень окисления С увеличивается)
Окисление – процесс перехода электронов
от субстрата к реагенту-окислителю,
«потеря электронов» атомом углерода
Слайд 5
Восстановление
замена связей
с электроотрицательными элементами на новые связи СН.
степень окисления
С уменьшается.Восстановление – процесс перехода электронов
от восстановителя к органическому субстрату.
- «приобретение электронов» атомом углерода
Слайд 6 Окисление органического соединения протекает тем легче, чем больше
выражена в нём тенденция к передаче электронов.
Слайд 10
Горение алканов
СН4
+ О2 СО2 + H2О + выделение тепла
и светаОкисление алканов сильными окислителями
RH + K2Cr2O7 + H2SO4, нагревание Смесь карбоновых кислот
Связи СС в насыщенных соединениях окисляются с большим трудом и всегда с разрушением соединения.
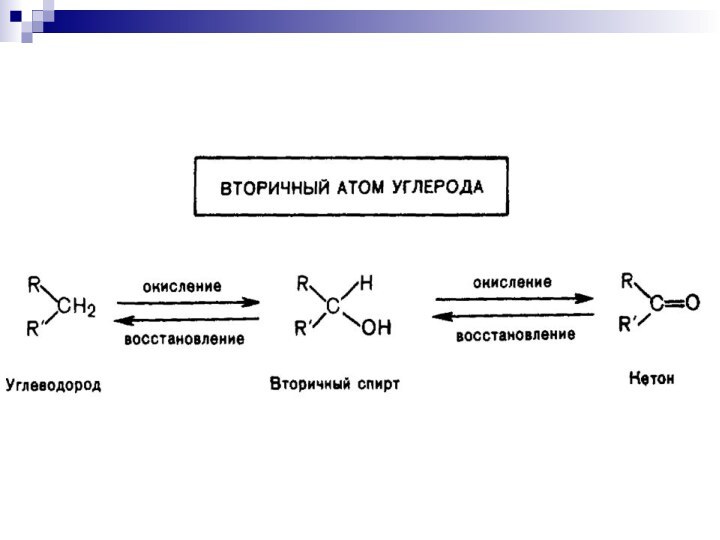
Слайд 16
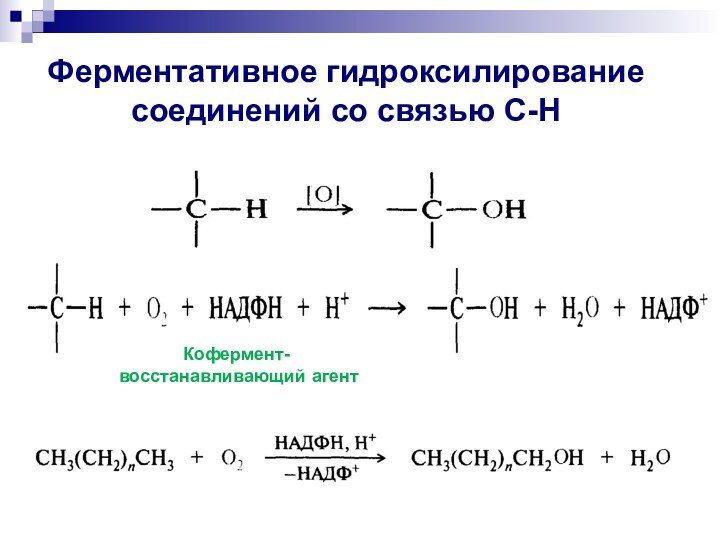
Ферментативное гидроксилирование соединений со связью С-Н
Кофермент-
восстанавливающий агент
Слайд 17
Коферменты: функции
Вспомогательные органические соединения небелковой
природы, входящие в состав некоторых ферментов.
Соединяясь с ферментом,
коферменты образуют каталитически активные комплексы. Многие коферменты - производные витаминов (В1, В2, В6, РР и др.).
выполняют функцию промежуточных переносчиков атомов или функциональных групп.
принято говорить о переносе восстановительных эквивалентов.
Слайд 18
озонолиз
эпоксидирование
гидроксилирование
озон
надкислоты
Окисление двойных
углерод-углеродных связей
перманганат калия
в слабощелочной среде
Мягкое окисление
Слайд 24
(причина канцерогенности многоядерных аренов)
Полиядерные арены способны окисляться
и
до эпоксидов:
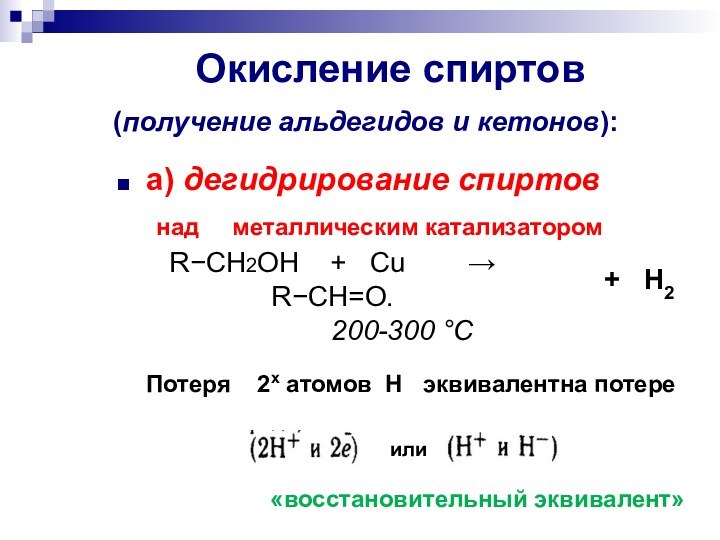
Слайд 25 Окисление спиртов (получение альдегидов и
кетонов):
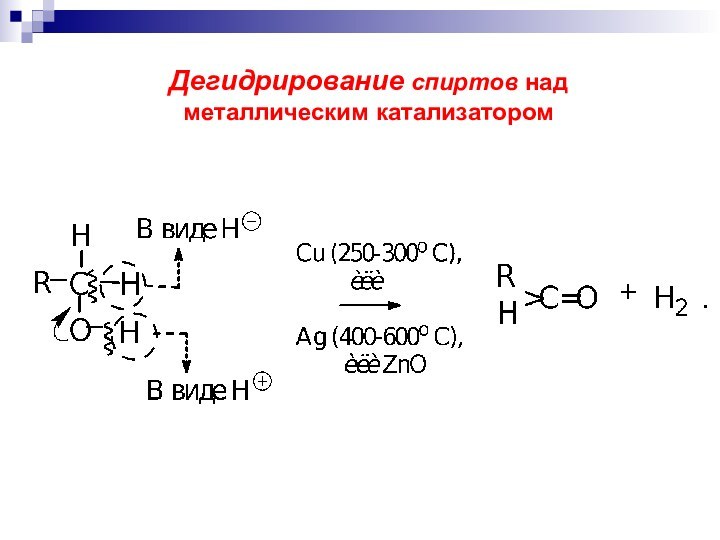
а) дегидрирование спиртов
над
металлическим катализатором RCH2OH + Cu RCH=O.
200-300 С
«восстановительный эквивалент»
Потеря 2х атомов Н эквивалентна потере
или
+ H2
Слайд 32
б) окисление спиртов сильными окислителями
RCH2OH + KMnO4
/ H2O RCOOK+ + MnO2
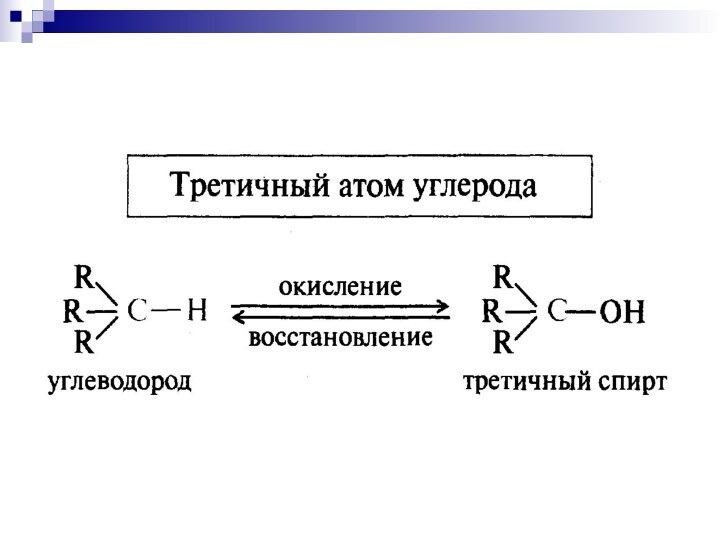
Третичные спирты в
нейтральной и щелочной средах не окисляются; в кислой среде происходит дегидратация спиртов до алкенов
первичные спирты
вторичные спирты
кетон
Слайд 33
Окисление альдегидов
RCH=O + [Ag(NH3)2]OH
RCOONH4 + Ag Реактив
ТолленсаРеакция "серебряного зеркала"
RCH=O + Cu(OH)2 + KOOC(CHOH)2COONa + KOH Реактив Фелинга (голубого цвета)
RCOOK + Cu2O↓ . Красный осадок
RCH2CH=O + SeO2 в CH3COOH RC(=O)CH=O.
α
α
Слайд 34 Концентрированная HNO3, хромовая смесь (K2Cr2O7 + H2SO4) или
KMnO4 в сильно кислой среде и при нагревании
Окисление кетонов
Слайд 37 Система хинон-гидрохинон участвует в процессе переноса электронов от
субстрата к кислороду.
Слайд 49
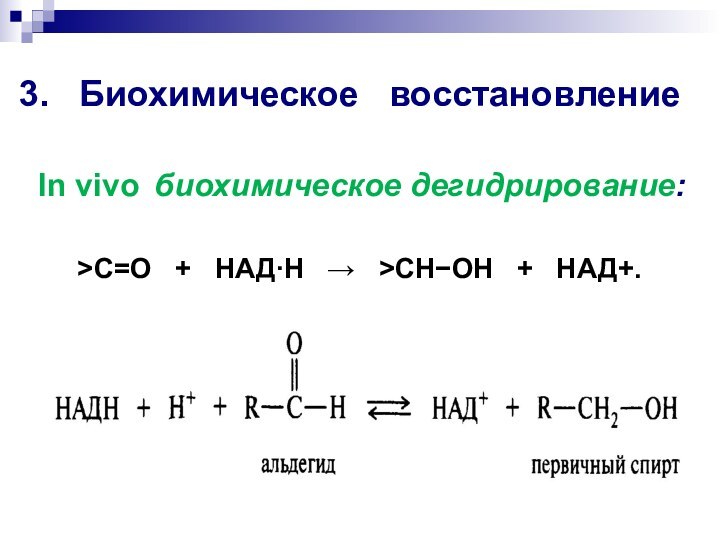
3. Биохимическое восстановление
>C=O +
НАДН >CHOH +
НАД+.
In vivo биохимическое дегидрирование:
Слайд 50
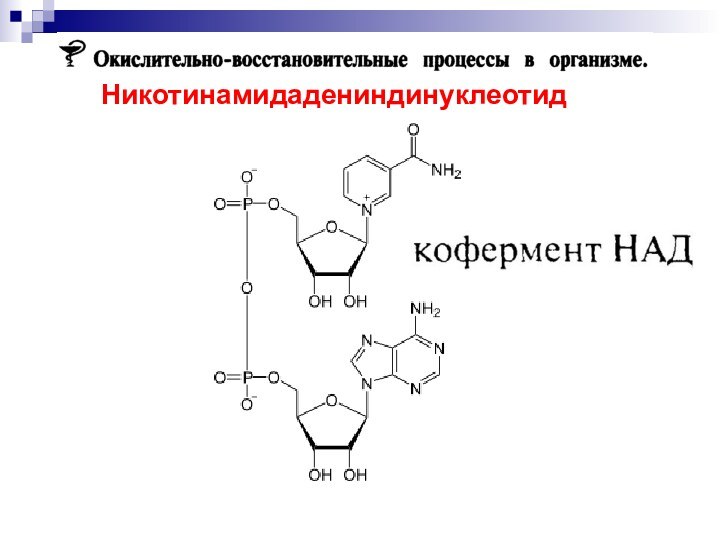
Никотинамидадениндинуклеотид
кофермент, присутствующий во всех живых клетках; входит в
состав ферментов группы дегидрогеназ, катализирующих окислительно-восстановительные реакции.
Открыт в
1904 в дрожжевом соке английскими биохимиками А. Гарденом и У. Йонгом; строение установлено в 1936 О. Варбургом и Х. Эйлером.
Все дегидрогеназы нуждаются в коферменте для переноса «восстановительных эквивалентов»
Слайд 51 ОТТО ГЕНРИХ ВАРБУРГ
(1883–1970),
немецкий биохимик и физиолог, удостоенный
в 1931 Нобелевской премии по физиологии и медицине за открытие природы и механизма действия дыхательных ферментов.
Слайд 54
Витамин В3,
витамин РР, ниацин
Недостаток витамина B3 приводит
к пеллагре— заболеванию, симптомами которого являются дерматит, диарея, деменеция
Слайд 55 Характерные симптомы пеллагры – поражения кожи, желудочно-кишечного тракта
и нервной системы:дерматит, диарея, деменеция
Слайд 56
Ароматический
пиридиниевый цикл.
Неароматический
1,4 –дигидропиридиновый цикл
Запас энергии
четвертичная соль
никотинамида
спирт
альдегид
Слайд 58 Передача запасённой энергии осуществляется при переходе НАДН
НАД+ в реакциях восстановления
Слайд 62 Восстановление с участием системы НАДН НАД+ является,
как и окисление, стереоселективным.
Слайд 64
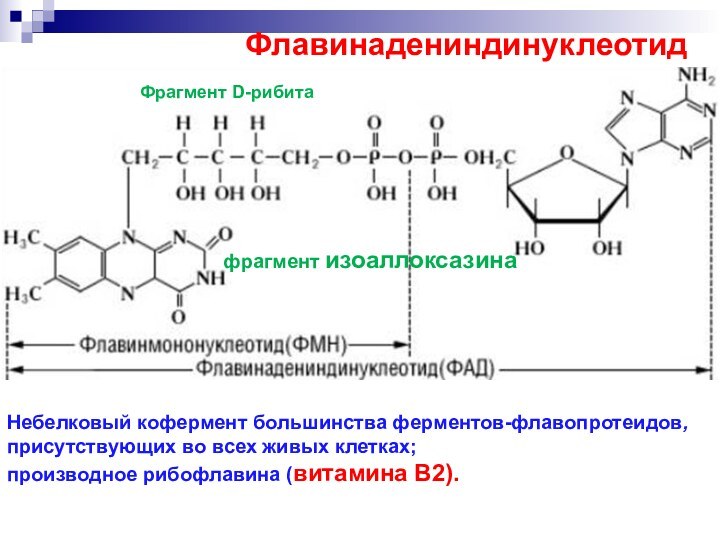
Флавинадениндинуклеотид
Небелковый кофермент большинства ферментов-флавопротеидов, присутствующих во всех
живых клетках;
производное рибофлавина (витамина В2).
Фрагмент D-рибита
фрагмент изоаллоксазина
Слайд 67 Витамин
В2
Функции:
энергетический обмен;
зрение;
кожа, ногти, слизистые оболочки;
образование красных кровяных клеток;
окислительно-восстановительные реакции;
антиоксидант;
рост и развитие.
Слайд 68
Источники:
дрожжи, листовые зелёные овощи, крупы
(гречневая и овсяная), горох, зародыши и оболочки зерновых культур,
хлеб;печень, почки, мясо, рыба, сыр, молоко, йогурт, прессованный творог, яичный белок.
Слайд 69
Последствия дефицита:
поражения
слизистых оболочек и кожного покрова;
жжение и зуд в
глазах, катаракты, чувствительность к свету; трещины на губах, хейлоз (дистрофия красной каймы губ), воспаления языка;
рвота, тошнота;
облысение;
бессонница;
дрожь;
заторможенность;
депрессия, раздражительность
Адекватный уровень потребления – 2 мг;
Слайд 70 Система переноса электронов с помощью гидрид-ионов Система хинон
гидрохинон.
В биологических системах этот перенос осуществляется группой
соединений хиноидной структуры (n = 610), называемых убихинонами, т.е. хинонами, присутствующими везде (ubiquitous повсеместный):
Слайд 73
Функции в организме:
*Обеспечивает выработку энергии на
клеточном уровне *Положительно влияет на сердечно-сосудистую систему, головной мозг и
периферическую нервную систему *Оказывает поддержку иммунной системе *Повышает регенеративные процессы слизистой оболочки десен и других быстрорастущихтканей
*Обладает антиоксидантной активностью
Слайд 74
Богатые источники CoQ10
говяжье сердце и другие внутренние органы,
яичный желток, печень, треска, молочный жир, различные виды цельного
зерна.В среднем человек потребляет приблизительно 5 мг CoQ10 в день