= Cu(OH)2 + 2KCl
2 группа:
CuBr2
+ Ba(OH)2 = Cu(OH)2 + BaBr2 3 группа:
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3
4 группа:
CuSO4 + 2KOH = Cu(OH)2 + K2SO4
5 группа:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть





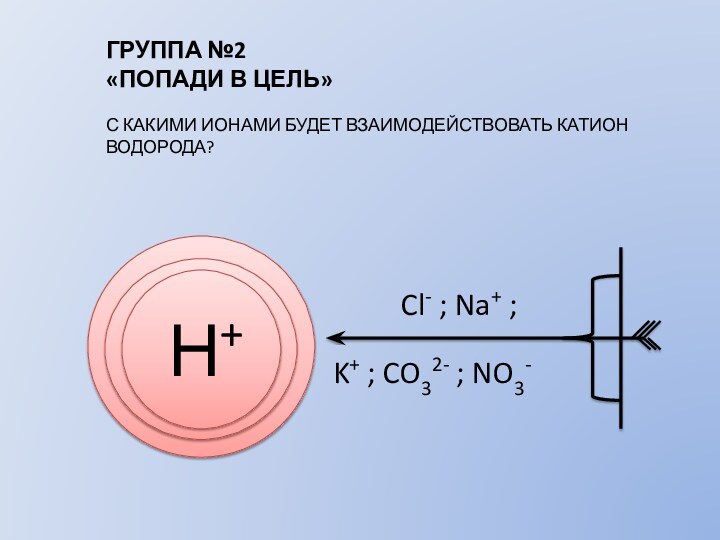
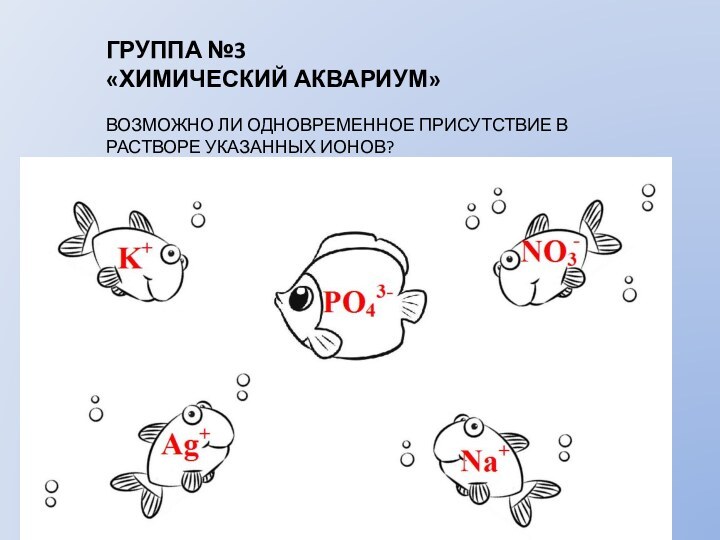
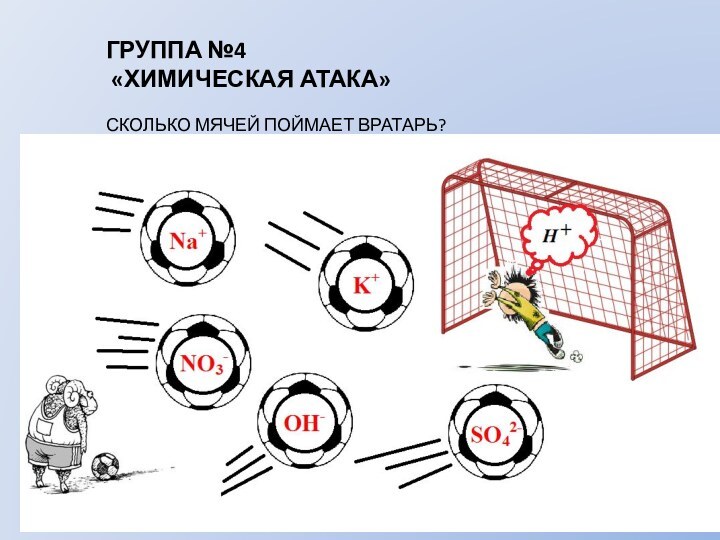






АЛГОРИТМ СОСТАВЛЕНИЯ ИОННЫХ УРАВНЕНИЙ
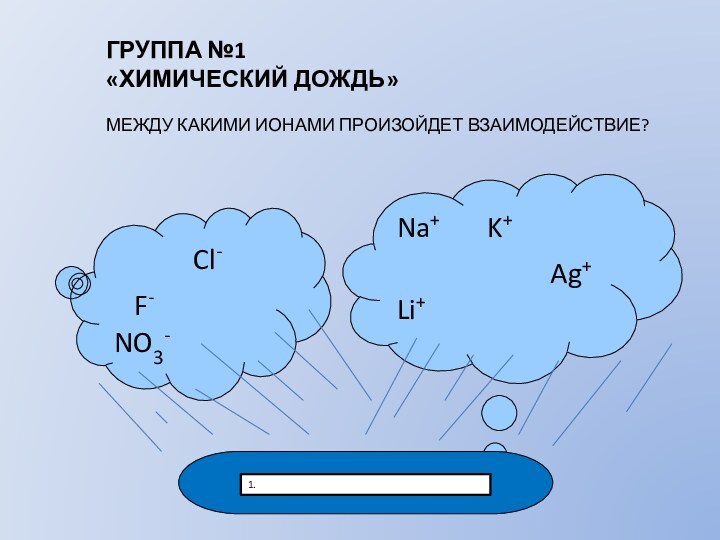
Na+ K+
Ag+ Li+
1.
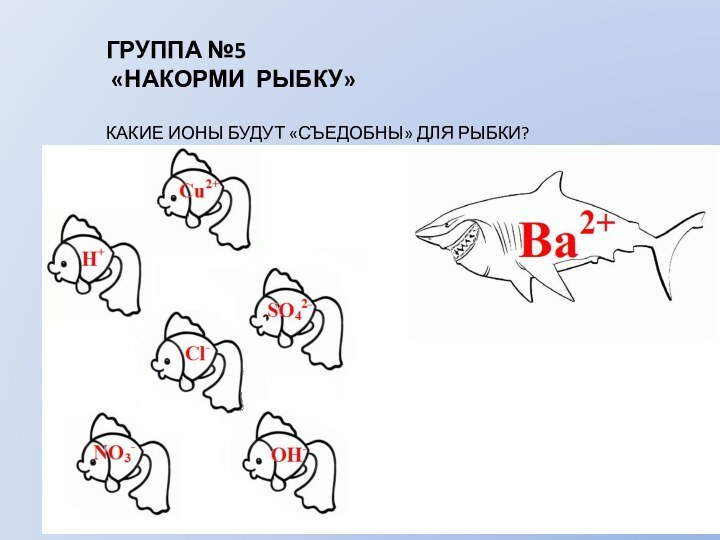
ГРУППА №1
«ХИМИЧЕСКИЙ ДОЖДЬ»
МЕЖДУ КАКИМИ ИОНАМИ ПРОИЗОЙДЕТ ВЗАИМОДЕЙСТВИЕ?