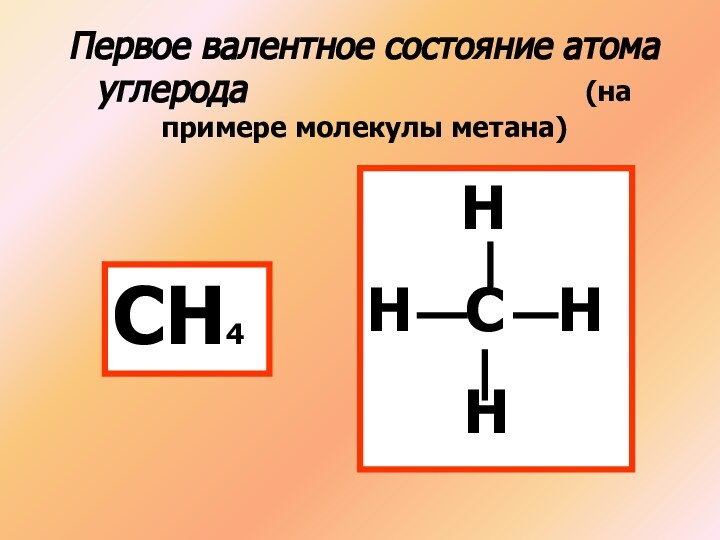
(на примере молекулы метана)
СН4
Н
Н С Н
Н
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть






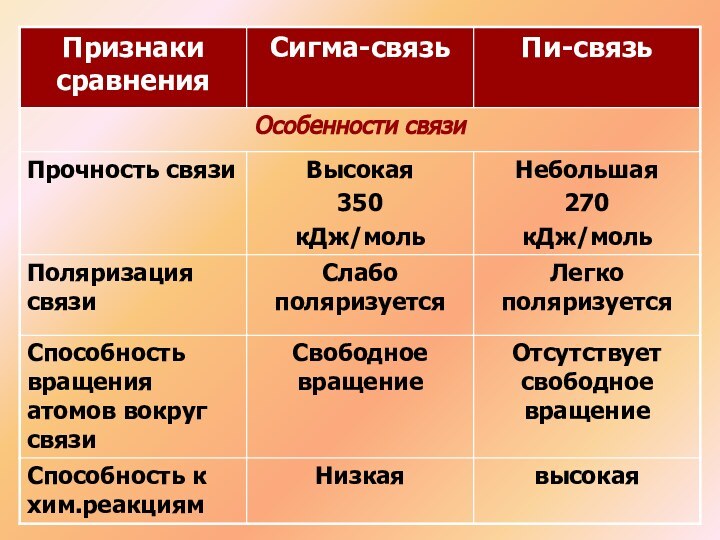

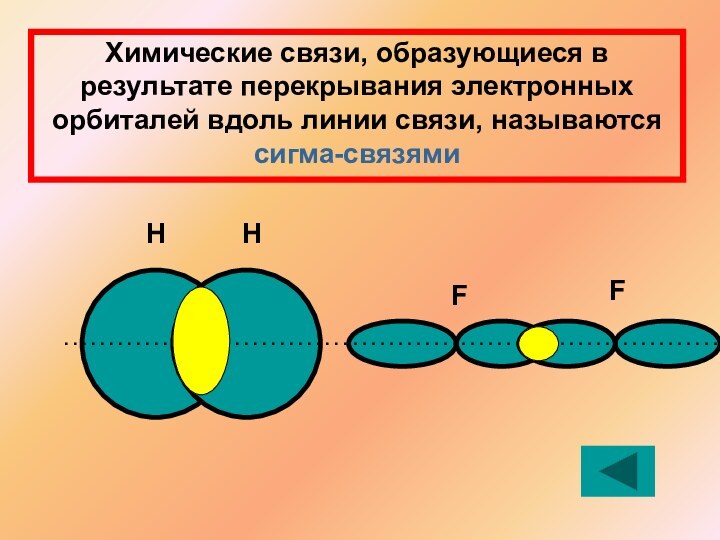
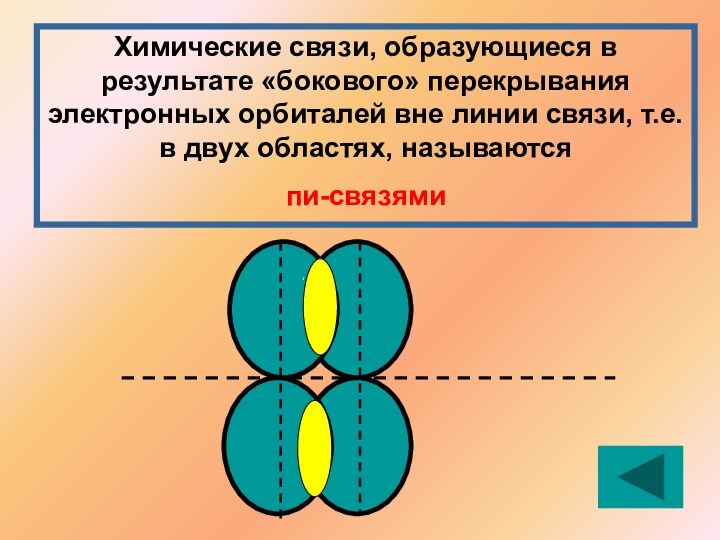
Решение:
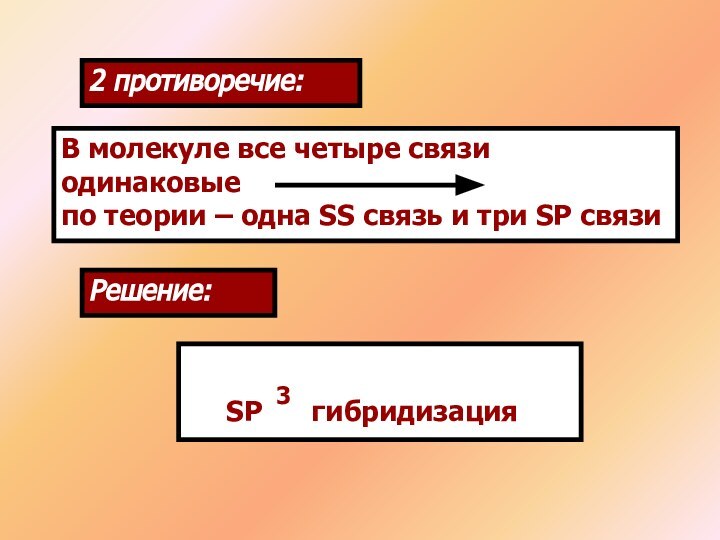
1 противоречие:
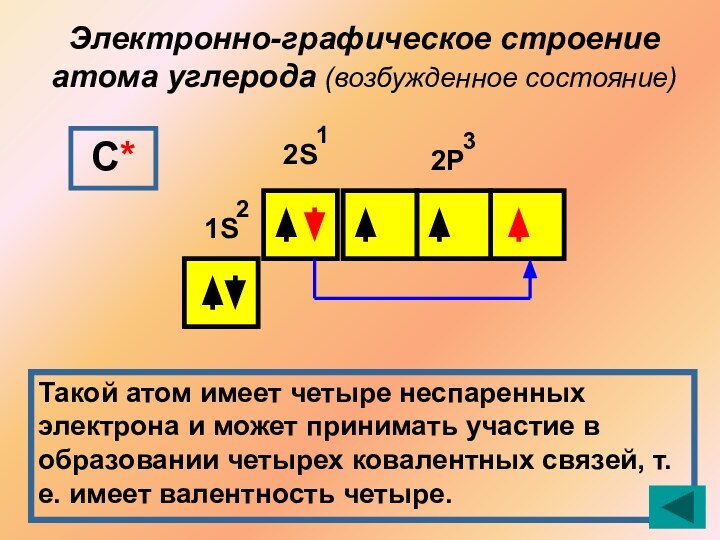
Выход в возбужденное состояние атома углерода
Решение:
SP гибридизация
3
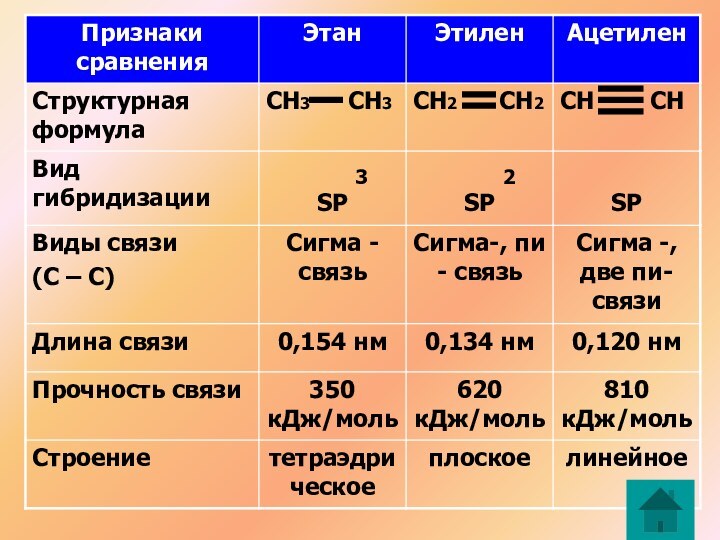
С2Н4
СН2 СН2
Атомы углерода в молекуле этилена образуют двойную связь, находятся в состоянии SP гибридизации
2
С2Н2
СН СН
Атомы углерода в молекуле ацетилена образуют тройную связь, находятся в состоянии SP гибридизации
1.
2.