периодической системе, строение их атомов
_
_
_
_
____ ______________
______ _ _______
Дмитрий Иванович
Менделеев
Выход
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть










_
_
____ ______________
______ _ _______
Дмитрий Иванович
Менделеев
Выход
________ ___________ _________
___________ _______
_______ _______
_________ ______
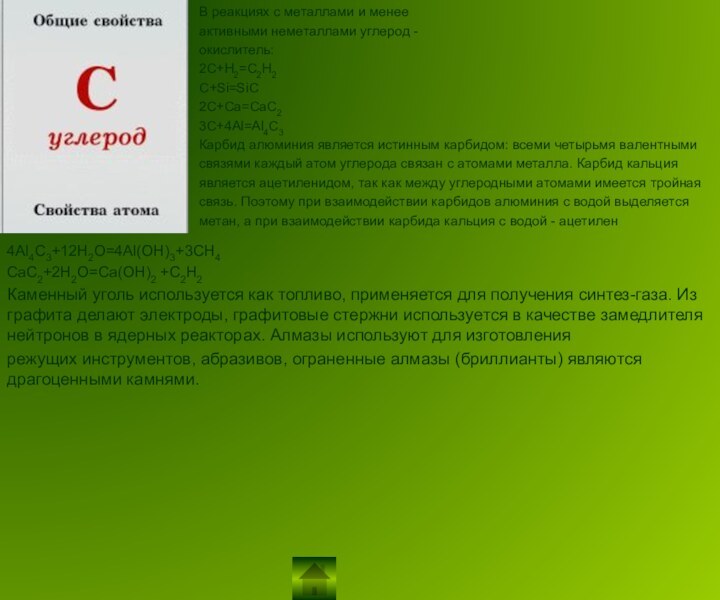
4Al4C3+12H2O=4Al(OH)3+3CH4
CaC2+2H2O=Ca(OH)2 +C2H2
Каменный уголь используется как топливо, применяется для получения синтез-газа. Из графита делают электроды, графитовые стержни используется в качестве замедлителя нейтронов в ядерных реакторах. Алмазы используют для изготовления
режущих инструментов, абразивов, ограненные алмазы (бриллианты) являются драгоценными камнями.