- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Основные понятия и законы химии
Содержание
- 2. Атом – наименьшая частица химического элемента, обладающая
- 3. Молекула – наименьшая частица вещества, способная
- 4. Если молекулы состоят из одинаковых атомов –
- 5. Относительная атомная масса ( Аr) – отношение
- 6. 1 моль – количество вещества (ν), содержащее
- 7. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ 1. Закон сохранения массы и
- 8. 2. Закон постоянства состава (Ж.Л.Пруст, 1808г) Каждое
- 9. 3. Закон простых объемных отношений (Гей-Люссак, 1808г) Объемы
- 10. 2 Н2(г) + О2(г) → 2 Н2О
- 11. 4. Закон Авогадро (1811г) В равных объемах любых
- 12. Следствия: Один моль любого газа при одинаковых
- 13. 2. Массы равных объемов двух газов, взятых
- 14. 5. Закон эквивалентов Химический эквивалент (Э, моль) –
- 15. Простые вещества:Сложные вещества:к – количество катионов (анионов);z - заряд катиона (аниона) по модулю.
- 17. Кислоты
- 18. Основания
- 19. Соли
- 20. Оксиды
- 21. Закон эквивалентов: Массы реагирующих друг с другом
- 22. ОСНОВНЫЕ ГАЗОВЫЕ ЗАКОНЫ1.Объединенный закон Бойля-Мариотта и Гей-Люссака
- 23. 2. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)R
- 24. 3. Закон парциальных давлений(закон Дальтона) Парциальное давление (р,
- 25. Закон Дальтона Давление смеси газов, химически не
- 26. Скачать презентацию
- 27. Похожие презентации
Атом – наименьшая частица химического элемента, обладающая его химическими свойствами. Химический элемент – вид атомов с одинаковым положительным зарядом ядра и определённой совокупностью свойств.









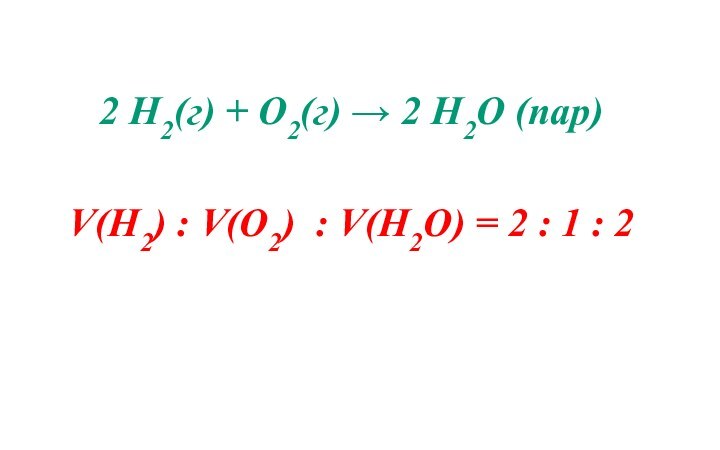





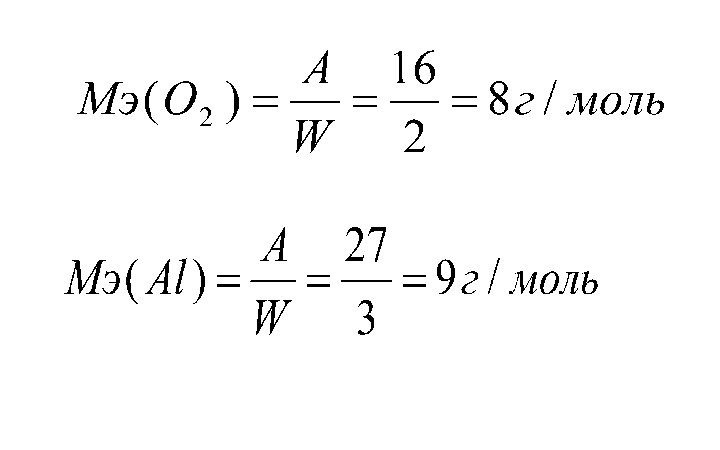
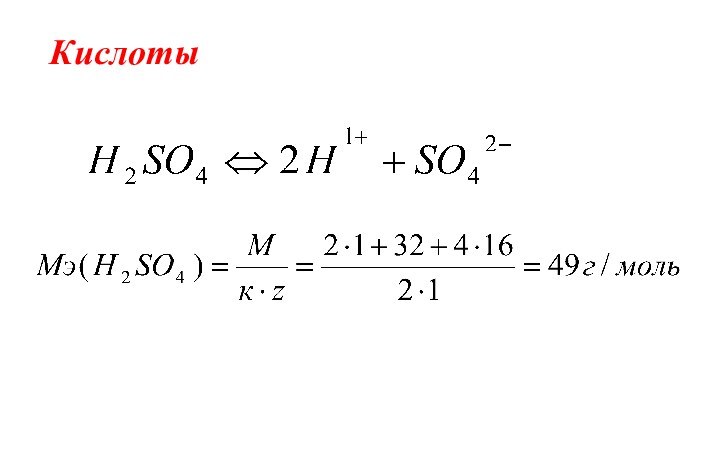
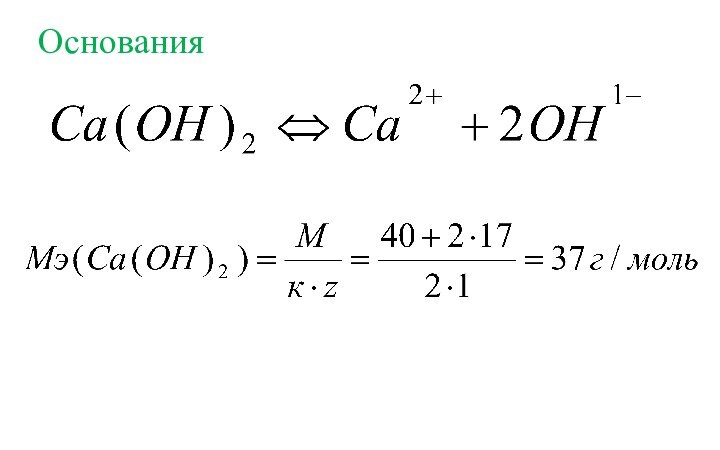
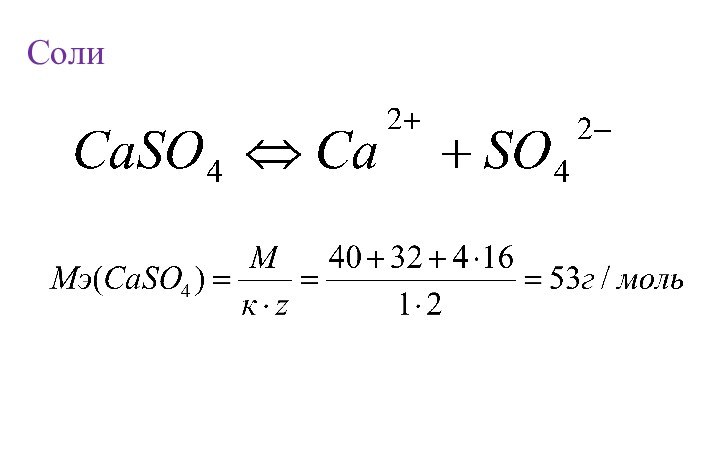
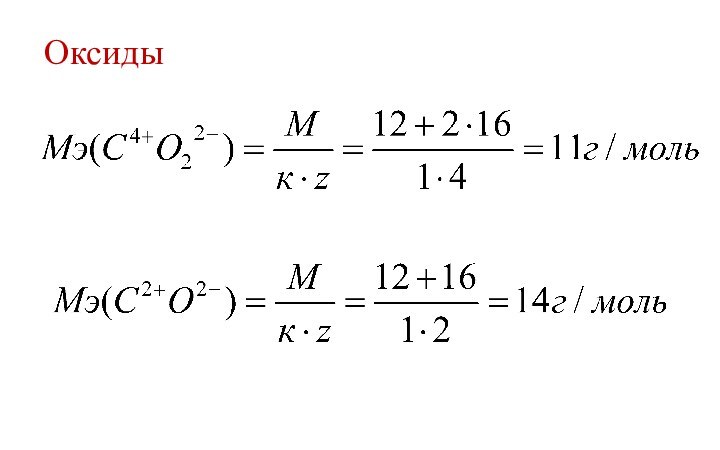






Слайд 2 Атом – наименьшая частица химического элемента, обладающая его
химическими свойствами.
положительным зарядом ядра и определённой совокупностью свойств.Слайд 3 Молекула – наименьшая частица вещества, способная к
самостоятельному существованию и обладающая основными химическими свойствами вещества.
Вещество –
устойчивое скопление частиц, обладающих массой покоя. Скопление частиц, не имеющих массу покоя – поле.
Слайд 4
Если молекулы состоят из одинаковых атомов – вещество
называется простым (Н2, О2, Cl2, Fe, Mn…), из разных
атомов - сложным или химическим соединением (СО2, H2SO4, FeCl3…).Слайд 5 Относительная атомная масса ( Аr) – отношение массы
данного атома к 1/12 части массы атома С-12 (
1,66 . 10 –27кг – 1 у.е.м.).Относительная молекулярная масса (Мr) – отношение массы данной молекулы к 1/12 части массы атома С-12. Она равна сумме масс всех атомов, входящих в состав молекулы.
Эти величины безразмерные.
Слайд 6 1 моль – количество вещества (ν), содержащее столько
же структурных единиц (молекул, атомов, ионов, электронов…), сколько содержится
атомов в 12 граммах изотопа С-12. В 12 г углерода содержится 6,022. 1023 атомов.NА = 6,022 . 1023 моль-1 – число Авогадро.
Масса одного моля вещества - молярная масса (М) [г/моль, кг/моль].
Слайд 7
ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
1. Закон сохранения массы и энергии
(Ломоносов 1760, Эйнштейн 1905)
В изолированной системе сумма масс и
энергий постоянна Е = m . c2
Слайд 8
2. Закон постоянства состава (Ж.Л.Пруст, 1808г)
Каждое химическое
соединение, независимо от способа его получения, всегда обладает постоянным
качественным и количественным составом.
Жозеф Луи Пруст
(1754—1826)
Слайд 9
3. Закон простых объемных отношений (Гей-Люссак, 1808г)
Объемы вступающих
в реакцию газов относятся между собой, а так же
к объемам образующихся газообразных продуктов при неизменных условиях, как небольшие целые числа. Ж. Л. Гей-Люссак
(1778 – 1850)
Слайд 11
4. Закон Авогадро (1811г)
В равных объемах любых газов,
взятых при одинаковых условиях, содержится одинаковое число частиц (молекул)
.
Амедео
Авогадро(1776 — 1856)
Слайд 12
Следствия:
Один моль любого газа при одинаковых условиях
занимает один и тот же объем
При Н.У. 1 моль
любого газа имеет объем Vm = 22,4 л/моль (молярный объем)
Н.У. Т0 = 273 К (0 0С);
Р0 = 101, 3 ∙ 103 Па = 760 мм.рт.ст. = 1 атм.
Слайд 13 2. Массы равных объемов двух газов, взятых при
одинаковых условиях, относятся друг к другу как
их молярные массы.- относительная плотность первого газа по второму, показывает во сколько раз один газ тяжелее другого.
Абсолютная плотность газа при н.у.
Слайд 14
5. Закон эквивалентов
Химический эквивалент (Э, моль) – это
такое количество вещества, которое соединяется с 1 молем атомов
водорода или замещает такое же количество атомов водорода в хим. реакции.Эквивалентная масса (МЭ, г/моль) – масса 1 химического эквивалента.
Слайд 15
Простые вещества:
Сложные вещества:
к – количество катионов (анионов);
z -
заряд катиона (аниона) по модулю.
Слайд 21 Закон эквивалентов: Массы реагирующих друг с другом веществ,
а так же продуктов реакции пропорциональны их эквивалентным массам.
А
+В = С
Слайд 22
ОСНОВНЫЕ ГАЗОВЫЕ ЗАКОНЫ
1.Объединенный закон Бойля-Мариотта и Гей-Люссака (закон
газового состояния)
Слайд 23
2. Уравнение состояния идеального газа
(уравнение Менделеева-Клапейрона)
R -
универсальная газовая постоянная
R = 8,314 Дж/моль∙К (СИ)
Р (Па); V(м3);
Т(К); m (г; кг); М (г/моль; кг/моль).
Слайд 24
3. Закон парциальных давлений
(закон Дальтона)
Парциальное давление (р, Па)
- это давление, которое производил бы данный газ, если
бы он при тех же условиях занимал объем всей газовой смеси.
Слайд 25
Закон Дальтона
Давление смеси газов, химически не взаимодействующих
друг с другом, равно сумме парциальных давлений газов,
составляющих смесь.Джон Дальтон
(1766 -1844)