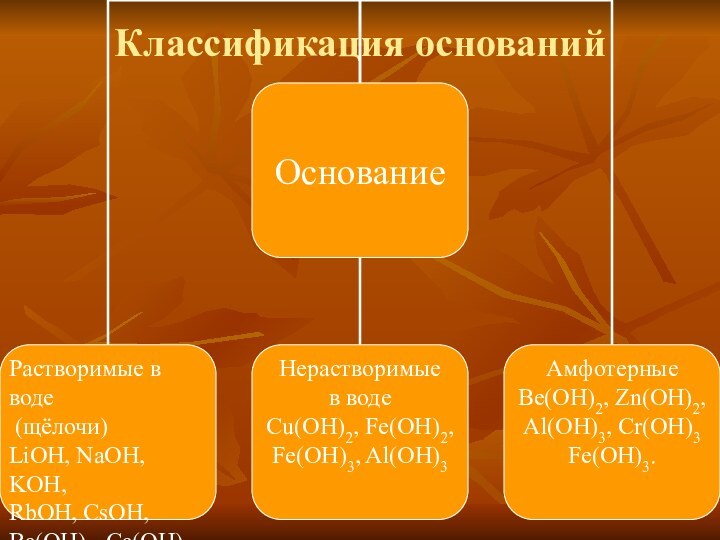
M(OH)n (M – металл, n – его валентность, обычно n
3) называются основаниями.Основания – это сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами.
Например, основаниями являются гидроксиды натрия NaOH, магния Mg(OH)2, железа (III) Fe(OH)3.