KI, HgCl2, CoCl2, …
валентнонасыщенные мол-лы (соединения первого порядка):
молекулярные соединения (соединения высшего порядка):
гидраты, аммиакаты,
двойные соли, …
CoCl3 + 6NH3 = CoCl3 · 6NH3
1.
HgCl2 + 2KI =HgI2↓ + 2KCl
HgI2 + 2KI = K2HgI4
2.
CuSO4 · 5H2O
K2SO4 · Al2(SO4)3
3.
4.



![Комплексные соединения [PtIV(NH3)6]Cl4[PtIV(NH3)5Cl]Cl3[PtIV(NH3)4Cl2]Cl2[PtIV(NH3)3Cl3]Cl[PtIV(NH3)2Cl4]От эмпирических формул КС к координационным:PtCl4 • 2NH3PtCl4 • 6NH3PtCl4 • 5NH3PtCl4 • 4NH3PtCl4 • 3NH3](/img/tmb/12/1114256/aab6808db15346d88ca2fb5bdb3db991-720x.jpg)
![Комплексные соединения NH3NH3NH3NH3NH3NH3CoIII[Co(NH3)6]3+ x + 0 = 3 IIIОктаэдр6](/img/tmb/12/1114256/b5615b9378ed7c3736031b6b48795d1e-720x.jpg)
![Комплексные соединения F–ЈF–ЈF–ЈBIII[BF4]– F–Јx – 4 = –1III4Тетраэдр](/img/tmb/12/1114256/c0bba31d876baa2161a96e1c624ecff2-720x.jpg)
![Комплексные соединения [PtCl4]2–Квадрат◒◒◒◒●Сl–Сl–ЈСl–Сl–x – 4 = –2 IIPtII4](/img/tmb/12/1114256/9cf7d2b793c9ca6c08d7186c8aff6413-720x.jpg)
![Комплексные соединения [Ag(CN)2]–◑◐●Линейная стуктура СN–CN–x – 2 = –1 IAgI2](/img/tmb/12/1114256/513e0179f7619ccad10f0fec97cebc93-720x.jpg)
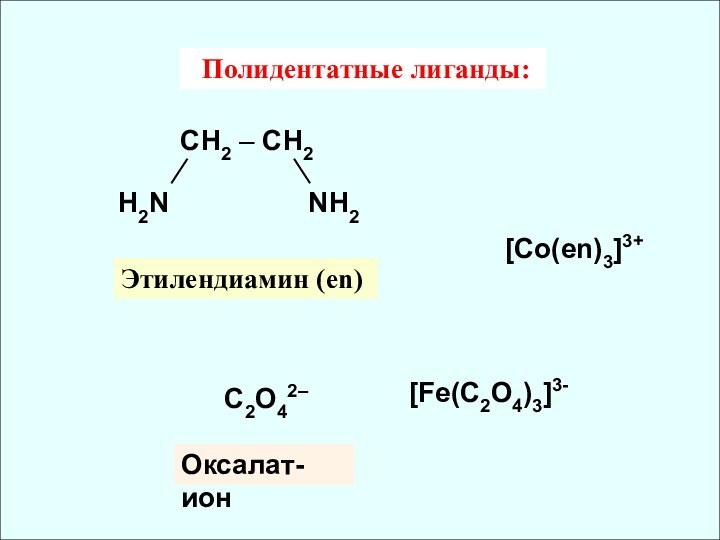

![Комплексные соединения [Zn(NH3)4]SO4 [Co(H2O)2(NH3)3Cl]Cl2 Хлорид хлоротриамминдиаквакобальта (III) Сульфат тетраамминцинка (II)x –](/img/tmb/12/1114256/836f6c31f795e41a32231325200be245-720x.jpg)
![Комплексные соединения Диссоциация КС в водных растворах[Cu(NH3)4]SO4 = [Cu(NH3)4]2+ +SO42–[Cu(NH3)4]2+ ⇄ Cu2+ + 4NH3](/img/tmb/12/1114256/864a6885b7ac89388b3c10bb9872c900-720x.jpg)
=](/img/tmb/12/1114256/40d7e5e976a648da7f93975fdc30a3ef-720x.jpg)
![Комплексные соединения Важнейшие типы КСAlCl3 ∙ 6H2O ≡ [Al(H2O)6]Cl3Если лигандами является вода комплексы называются](/img/tmb/12/1114256/250b172d0e562559eb218d8dfbfe0c61-720x.jpg)
![Комплексные соединения Амминокомплексы2.В амминокомплексах лигандами являются молекулы NH3[Cu(NH3)4]2+[Ni(NH3)6]2+ZnSO4 + 2NH3 ∙ H2O = Zn(OH)2↓](/img/tmb/12/1114256/aac4dae3fdf1cf5cab39f8b3b08888a7-720x.jpg)

![Комплексные соединения Be(OH)2 + 2NaOH = Na2[Be(OH)4]Гидроксокомплексы4.В гидроксокомплексах лигандами являются ионы ОН-Na3[Al(OH)6]K2[Sn(OH)6]BeCl2 + 2NaOH](/img/tmb/12/1114256/56f5ec1394d34522a093a55deefbcb91-720x.jpg)
![Комплексные соединения [Cu(NH3)4]2+](/img/tmb/12/1114256/81887c4711d907fbb87351d5aca1558c-720x.jpg)
![Комплексные соединения Природа химической связи в КС[Zn(NH3)4]Cl2 ⮦ Ионная связьКовалентная связь ⮥ ? –](/img/tmb/12/1114256/68ad375cc83493f8f75bac5a698af184-720x.jpg)
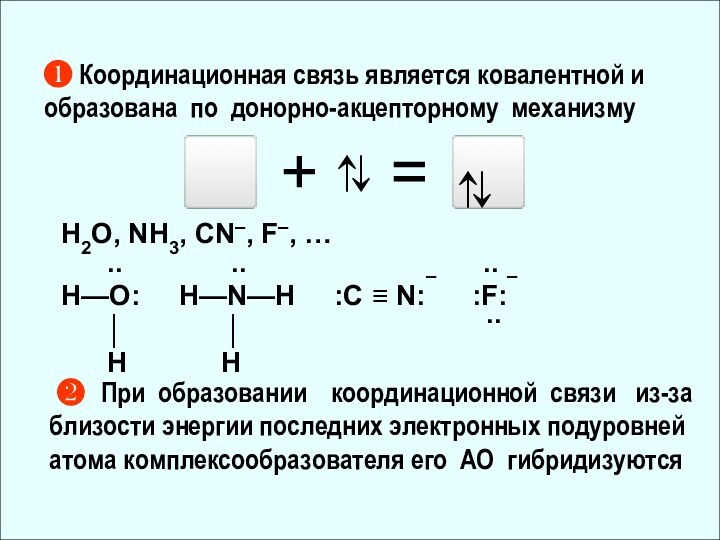
3Cr0 [Ar] 3d54s1 Cr3+](/img/tmb/12/1114256/0d2d6baf967d582c3867d391170686da-720x.jpg)
![Комплексные соединения K4[Fe(CN)6]Fe0 [Ar] 3d64s2 Fe2+](/img/tmb/12/1114256/5ce6fc007995b96de4538630f5d18865-720x.jpg)
![Комплексные соединения [Ni(NH3)6]Br2Ni0 [Ar] 3d84s2 Ni2+](/img/tmb/12/1114256/77160e8d4c18d111722385831f63bf96-720x.jpg)
![Комплексные соединения Na2[Zn(OH)4]Zn0 [Ar] 3d104s2 Zn2+](/img/tmb/12/1114256/591277fc828f7b94fe5cf8350d742e5d-720x.jpg)
![Комплексные соединения K2[Ni(CN)4]Ni0 [Ar] 3d84s2 Ni2+](/img/tmb/12/1114256/88c1b3ffff504d00d1ef2e36a09f481c-720x.jpg)
![Комплексные соединения [Ag(NH3)2]ClAg0 [Kr] 4d105s1 Ag+](/img/tmb/12/1114256/744e360a1395426bfd380cff50375fff-720x.jpg)





























