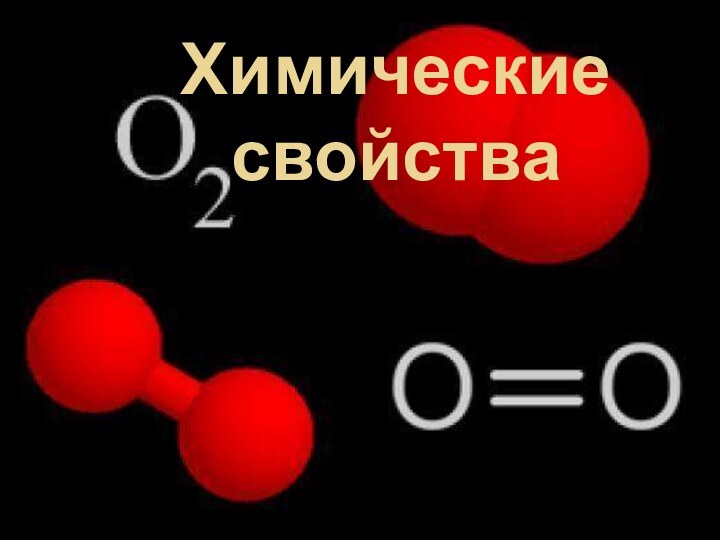
электрона находятся на внутреннем уровне, а 6 электронов – на внешнем.
Поэтому в химических реакциях кислород может принимать от доноров до двух электронов, достраивая свою внешнюю оболочку до 8 электронов и образуя избыточный отрицательный заряд
СТРОЕНИЕ АТОМА