- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему КАРБОНОВЫЕ КИСЛОТЫ
Содержание
- 2. СодержаниеОпределениеКлассификация кислотНоменклатураИзомерияПолучение Химические свойства (как минеральные кислотыкислоты; специфические свойства )ПрименениеИсточники информации
- 3. Определение Карбоновыми кислотами называются производные углеводородов, в молекуле
- 4. Классификация кислотВ зависимости от природы радикала, связанного
- 5. Дайте классификацию следующим кислотам:
- 6. HCOOH Муравьиная (метановая)
- 7. Номенклатура В систематической номенклатуре кислот действуют следующие правила:1.
- 8. 4
- 9. Изомерия1)углеродного скелетаCH3 – CH2 – CH2 –
- 10. Получение:1.Вытеснение кислот из солей более сильной кислотой
- 11. 3.Окисление альдегидов (в лаб.- Ag2O;Cu(OH)2; в пром.-
- 12. Реакция «серебряного зеркала»
- 13. Окисление альдегидов гидроксидом меди (II) (реакция «медного
- 14. Химические свойства I.Карбоновые кислоты обладают свойствами, характерными
- 15. 2. Они реагируют с активными металлами. 2СH3COOH +
- 16. 5. Реагируют с солями слабых кислот. 2СH3CH2COOH
- 17. II.Специфические свойства карбоновыхкислот.7. Реакция этерификации.
- 18. Внимание! Реакция образования сложного эфира из кислоты и спирта называется реакцией этерификации.
- 19. 8. При воздействии водоотнимающих реагентов в результате
- 20. 9. Галогенирование. У карбоновых кислот под влиянием
- 21. 10. Восстановление и каталитическое гидрирование (с большим
- 22. Применение Муравьиная кислота – в медицине, в
- 23. Масляная кислота – для получения ароматизирующих добавок,
- 24. Источники информации 1. Петров А.А., Бальян Х.В., Трощенко
- 25. Скачать презентацию
- 26. Похожие презентации
СодержаниеОпределениеКлассификация кислотНоменклатураИзомерияПолучение Химические свойства (как минеральные кислотыкислоты; специфические свойства )ПрименениеИсточники информации
















Слайд 2
Содержание
Определение
Классификация кислот
Номенклатура
Изомерия
Получение
Химические свойства (как минеральные
кислотыкислоты; специфические
свойства )
Слайд 3
Определение
Карбоновыми кислотами называются
производные углеводородов, в молекуле
которых
содержится одна или несколько
карбоксильных групп –COOH.
Общая формула карбоновых
кислот: R – C = O
|
OH
Слайд 4
Классификация кислот
В зависимости от природы радикала, связанного с
карбоксильной группой, кислоты подразделяются на предельные, непредельные и ароматические.
По
числу карбоксильных групп делятся на одноосновные и многоосновные кислоты.Общая формула предельных одноосновных кислот: СnH2n+1COOH (или СnH2nO2).
Слайд 5
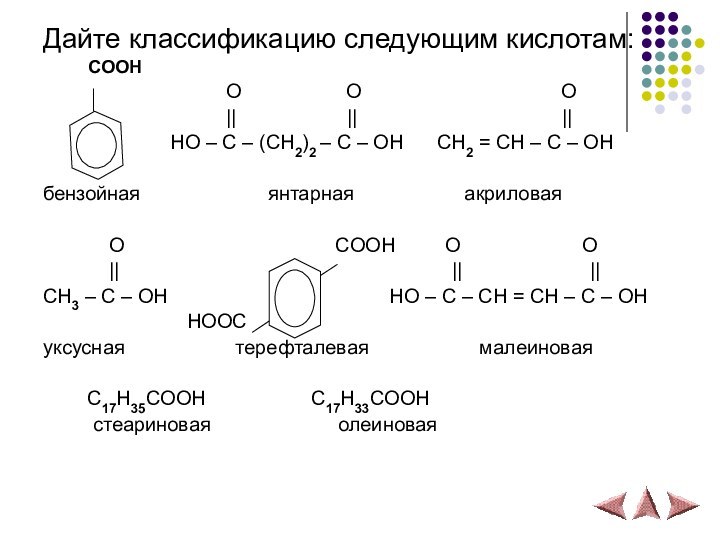
Дайте классификацию следующим кислотам:
COOH
O O O || || ||
HO – C – (CH2)2 – C – OH CH2 = CH – C – OH
бензойная янтарная акриловая
O COOH O O
|| || ||
CH3 – C – OH HO – C – CH = CH – C – OH
HOOC
уксусная терефталевая малеиновая
C17H35COOH C17H33COOH
стеариновая олеиновая
Слайд 6 HCOOH Муравьиная (метановая) -
формиат
CH3COOH Уксусная (этановая) -
ацетатCH3CH2COOH Пропионовая (пропановая) - пропионат
CH3(CH2)2COOH Масляная (бутановая) - бутират
CH3(CH2)3COOH Валериановая (пентановая)-валерат
CH3(CH2)4COOH Капроновая (гексановая) - гексанат
CH3(CH2)6COOH Каприловая (октановая) - октаноат
CH3(CH2)8COOH Каприновая (декановая) - деканоат
CH2=CH–COOH Акриловая (пропеновая) - акрилат
C6H5COOH Бензойная (бензойная) - бензоат
HOOC–COOH Щавелевая (этандиовая) - оксалат
CH3(CH2)14COOH Пальмитиновая (гексадекановая)
- пальмиат
CH3(CH2)16COOH Стеариновая (октадекановая)
- стеарат
Слайд 7
Номенклатура
В систематической номенклатуре кислот действуют
следующие правила:
1. Главная
цепь должна начинаться и нумероваться с
карбоксильной группы.
2. В
префиксе указываются положение и названия заместителей.
3. После корня указывающего число атомов в цепи
идет суффикс, показывающий наличие или отсутствие
двойных, тройных связей, их положение.
4. После этого добавляется «– овая кислота». Если
карбоксильных групп несколько, то перед – овая
ставится числительное (ди –, три –… ).
Слайд 8 4 3
2
1CH3 – CH2 – CH – COOH 2 – метилбутановая кислота
|
OH
5 4 3 2 1
H2C = C – C = CH – COOH 3,4-диметилпентадиен-2,4-
| | овая кислота
CH3 CH3
CH3 CH3
| |
HOOC – C = C – COOH 2,3-диметилбутен-2-диовая
1 2 3 4 кислота
Слайд 9
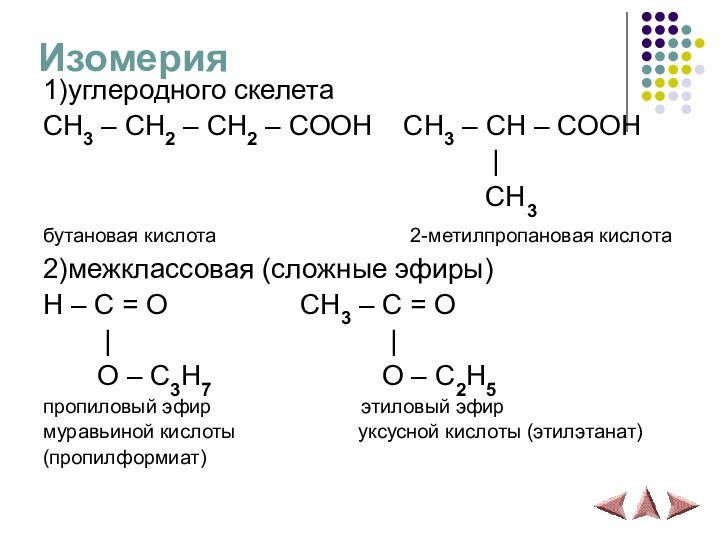
Изомерия
1)углеродного скелета
CH3 – CH2 – CH2 – COOH
CH3 – CH – COOH
|CH3
бутановая кислота 2-метилпропановая кислота
2)межклассовая (сложные эфиры)
H – C = O CH3 – C = O
| |
O – C3H7 O – C2H5
пропиловый эфир этиловый эфир
муравьиной кислоты уксусной кислоты (этилэтанат)
(пропилформиат)
Слайд 10
Получение:
1.Вытеснение кислот из солей более
сильной кислотой (лаб.
способ):
2CH3COONa + H2SO4 →
Na2SO4 + 2CH3COOHконц. t
2.Окисление первичных спиртов:
C2H5OH + O2 → CH3COOH + H2O
t,Cu
Слайд 11
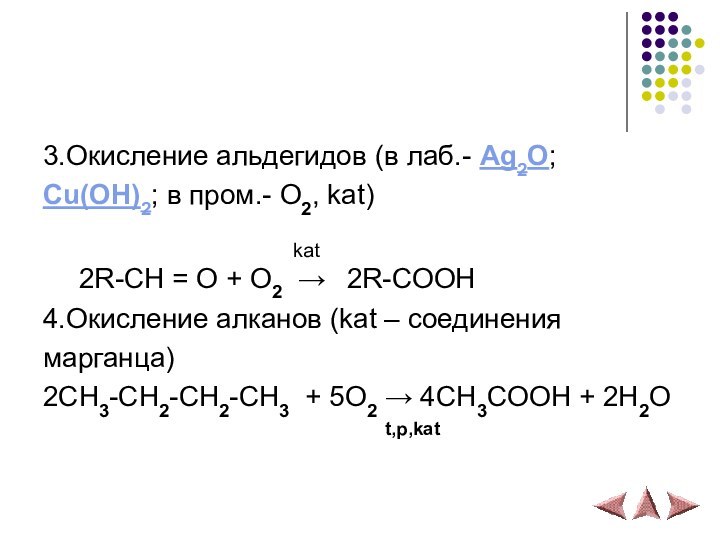
3.Окисление альдегидов (в лаб.- Ag2O;
Cu(OH)2; в пром.- O2,
kat)
kat2R-CH = O + O2 → 2R-COOH
4.Окисление алканов (kat – соединения
марганца)
2CH3-CH2-CH2-CH3 + 5O2 → 4CH3COOH + 2H2O
t,p,kat
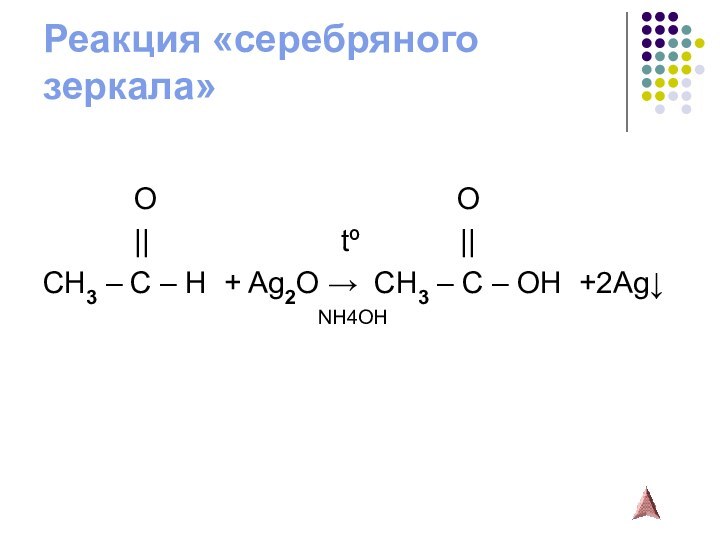
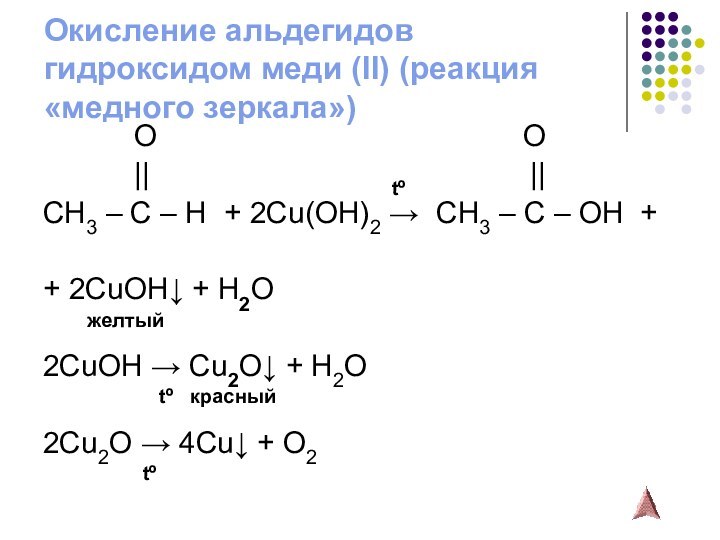
Слайд 13
Окисление альдегидов
гидроксидом меди (II) (реакция «медного зеркала»)
O
O|| tº ||
CH3 – C – H + 2Cu(OH)2 → CH3 – C – OH +
+ 2CuOH↓ + H2O
желтый
2CuOH → Cu2O↓ + H2O
tº красный
2Cu2O → 4Cu↓ + O2
tº
Слайд 14
Химические свойства
I.Карбоновые кислоты обладают
свойствами, характерными для минеральных
кислот.
1.Из-за смещения электронной плотности от
гидроксильной группы O–H к
сильно поляризованной карбонильной группе C=O
молекулы карбоновых кислот способны к
электролитической диссоциации:
R–COOH → R–COO- + H+
Слайд 15
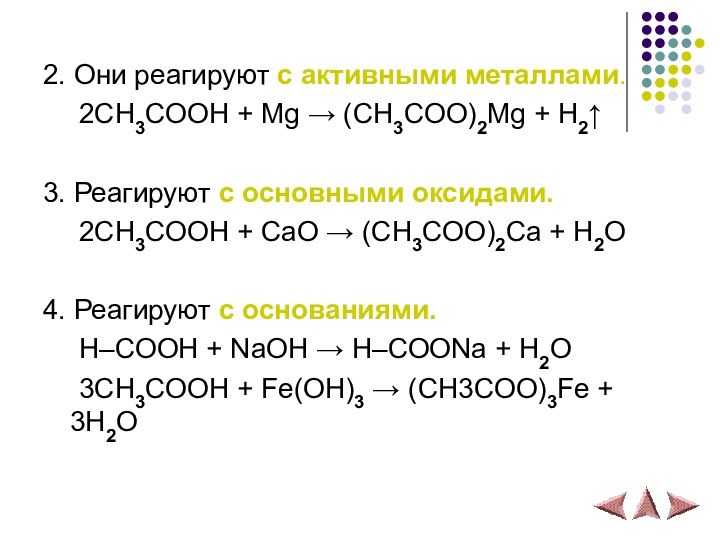
2. Они реагируют с активными металлами.
2СH3COOH + Mg
→ (CH3COO)2Mg + H2↑
3. Реагируют с основными оксидами.
2СH3COOH
+ СaO → (CH3COO)2Ca + H2O4. Реагируют с основаниями.
H–COOH + NaOH → H–COONa + H2O
3CH3COOH + Fe(OH)3 → (CH3COO)3Fe + 3H2O
Слайд 16
5. Реагируют с солями слабых кислот.
2СH3CH2COOH +
Na2CO3 →
→ 2CH3CH2COONa + H2O + CO2↑СH3CH2COOH + NaHCO3 → CH3CH2COONa +
+ H2O + CO2↑
6. Реагируют с аммиаком (как основанием)
СH3COOH + NH3 → СH3COONH4
ацетат аммония
Карбоновые кислоты слабее многих
сильных минеральных кислот (HCl, H2SO4 и
т.д.) и поэтому вытесняются ими из солей:
СH3COONa + H2SO4 → CH3COOH + NaHSO4
конц. tº
Слайд 17
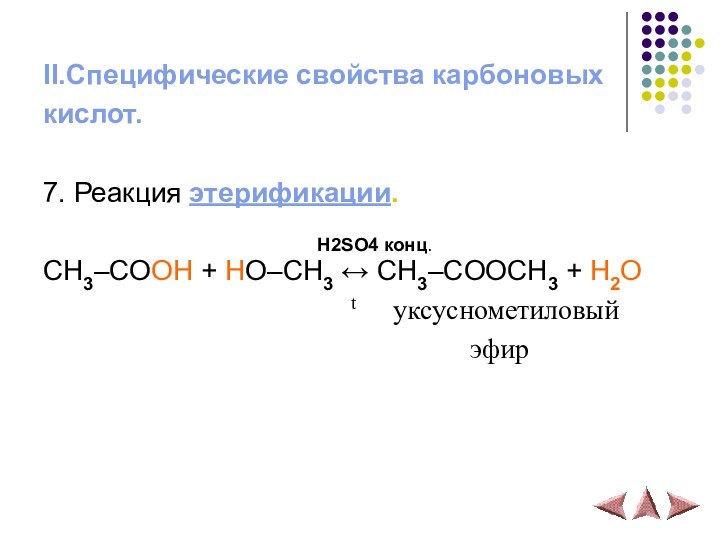
II.Специфические свойства карбоновых
кислот.
7. Реакция этерификации.
H2SO4 конц.
CH3–COOH + HO–CH3 ↔ CH3–COOCH3 + H2O
t уксуснометиловый
эфир
Слайд 18
Внимание!
Реакция образования сложного эфира
из кислоты и спирта
называется
реакцией этерификации.
Слайд 19
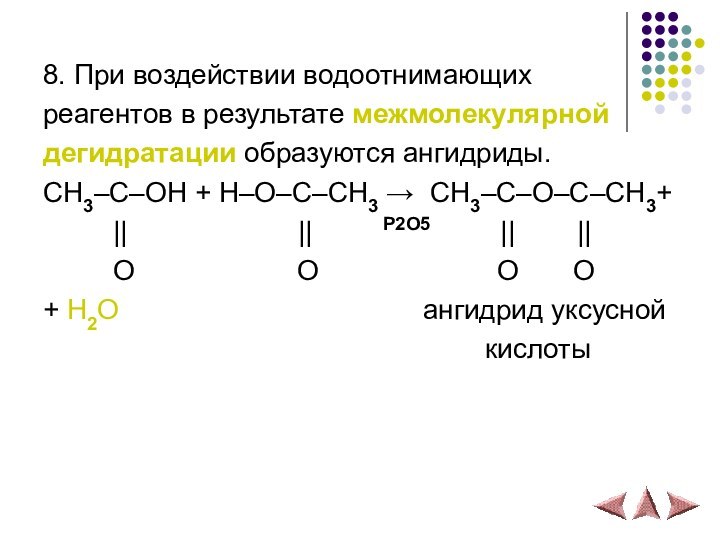
8. При воздействии водоотнимающих
реагентов в результате межмолекулярной
дегидратации образуются ангидриды.
CH3–С–OH + H–O–С–CH3 → CH3–С–O–С–CH3+
|| || P2O5 || ||O O O O
+ H2O ангидрид уксусной
кислоты
Слайд 20
9. Галогенирование. У карбоновых кислот
под влиянием карбоксильной
группы
Увеличивается подвижность атомов
водорода, стоящих при атоме углерода,
соседним с карбоксильной группой. Поэтому
они могут быть легко замещены на атомы
хлора или брома:
СH3COOH+ Cl2 → СH2ClCOOH + HCl
2-хлорэтановая кислота
(хлоруксусная кислота)
α-Галогензамещённые кислоты – более
сильные кислоты, чем карбоновые.
Хлоруксусная кислота в 100 раз сильнее
уксусной.
Слайд 21
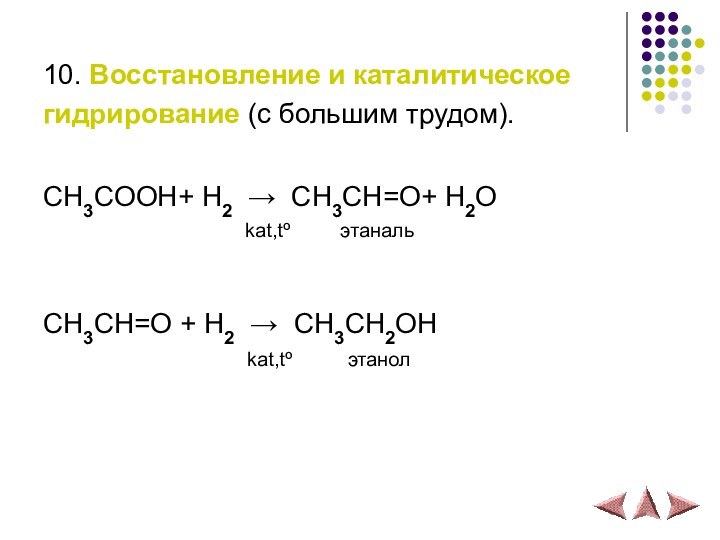
10. Восстановление и каталитическое
гидрирование (с большим трудом).
СH3COOH+ H2 → СH3CH=O+ H2O
kat,tº этанальСH3CH=O + H2 → СH3CH2OH
kat,tº этанол
Слайд 22
Применение
Муравьиная кислота – в медицине, в
пчеловодстве,
в органическом синтезе, при
получении растворителей и консервантов; в
качестве сильного восстановителя.
Уксусная кислота – в пищевой и химической
промышленности (производство
ацетилцеллюлозы, из которой получают
ацетатное волокно, органическое стекло,
киноплёнку; для синтеза красителей,
медикаментов и сложных эфиров).
Слайд 23
Масляная кислота – для получения
ароматизирующих добавок, пластификато-
ров
и флотореагентов.
Щавелевая кислота – в металлургической
промышленности (удаление окалины).
Стеариновая
C17H35COOH и пальмитиновая кислота C15H31COOH – в
качестве поверхностно-активных веществ,
смазочных материалов в металлообработке.
Олеиновая кислота C17H33COOH –
флотореагент и собиратель при обогащении
руд цветных металлов.
Слайд 24
Источники информации
1. Петров А.А., Бальян Х.В., Трощенко А.Т.
Органическая химия. Учебник для вузов./
Под ред. Петрова А.А.
– М.: Высшая школа,1981.
2. Хомченко Г.П. Пособие по химии для
поступающих в вузы. – М.: ООO «Издательство
Новая Волна», 2002.
3. Потапов В.М., Чертков И.Н. Строение и
свойства органических веществ. Пособие для
учащихся 10 кл. – М.: Просвещение, 1980.





























