- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Хлороводород. Соляная кислота
Содержание
- 2. Хлороводород HClHCl – это бесцветный газ с
- 3. Получение HClВ лаборатории:
- 4. Соляная кислота HClСоляная кислота сильная, т.е. в
- 5. Химические свойстваКислотные свойстваА. Взаимодействие с металлами, стоящими
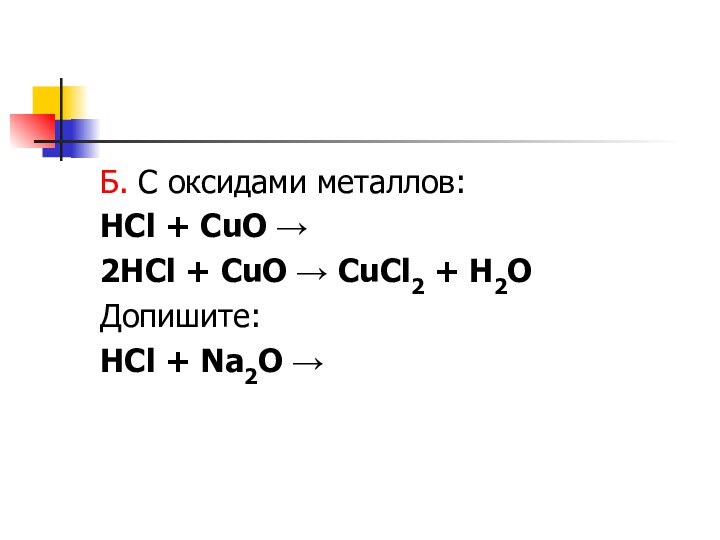
- 6. Б. С оксидами металлов:HCl + CuO →
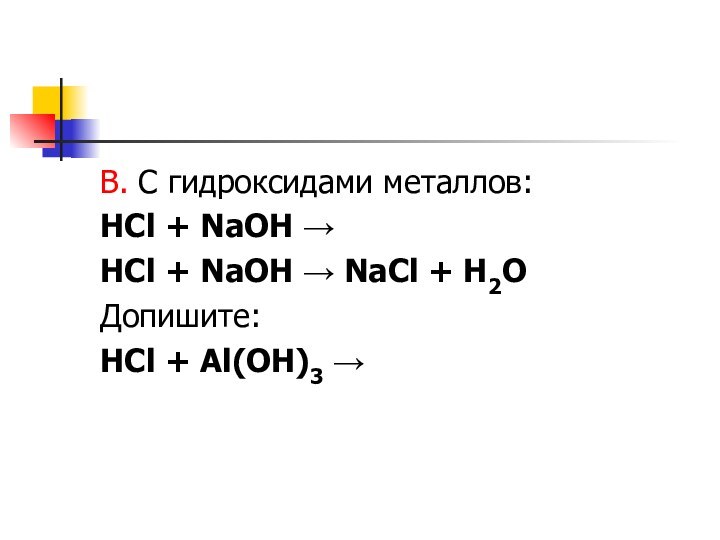
- 7. В. С гидроксидами металлов:HCl + NaOH →
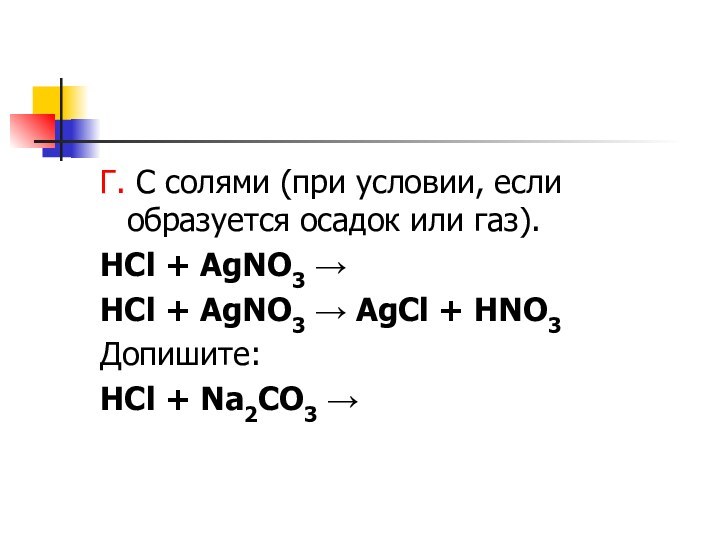
- 8. Г. С солями (при условии, если образуется
- 9. 2. Восстановительные свойства.4HCl + MnO2 → MnCl2
- 10. Скачать презентацию
- 11. Похожие презентации
Хлороводород HClHCl – это бесцветный газ с резким неприятным запахом, тяжелее воздуха.Докажем это:М (HCl)= 1+35,5=36,5 г/мольМ (воздуха)= 29 г/моль






Слайд 2
Хлороводород HCl
HCl – это бесцветный газ с резким
неприятным запахом, тяжелее воздуха.
29 г/моль
Слайд 3
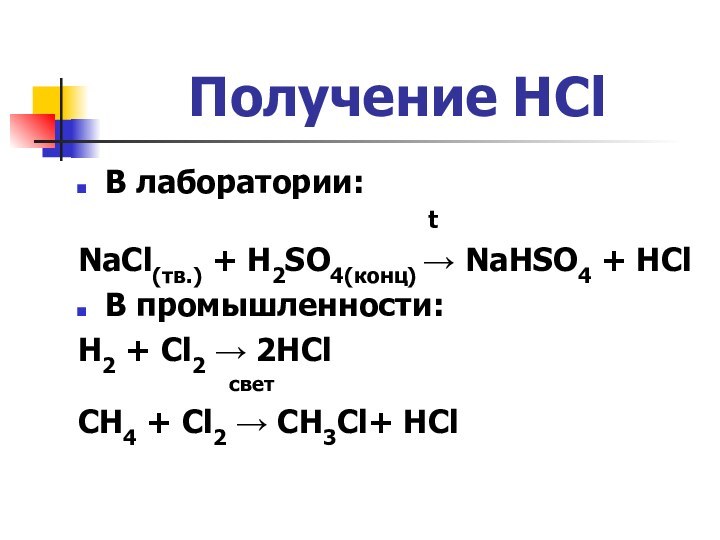
Получение HCl
В лаборатории:
t
NaCl(тв.) + H2SO4(конц) → NaHSO4 + HCl
В промышленности:
H2 + Cl2 → 2HCl
свет
CH4 + Cl2 → CH3Cl+ HCl
Слайд 4
Соляная кислота HCl
Соляная кислота сильная, т.е. в водных
растворах полностью распадается на ионы:
HCl → H+ + Cl-Растворы кислоты не имеют запаха.
Слайд 5
Химические свойства
Кислотные свойства
А. Взаимодействие с металлами, стоящими в
ряду активности до водорода:
HCl + Zn →
2HCl +
Zn → ZnCl2 + H2Допишите:
HCl + Al →
Слайд 8 Г. С солями (при условии, если образуется осадок
или газ).
HCl + AgNO3 →
HCl + AgNO3 →
AgCl + HNO3Допишите:
HCl + Na2CO3 →
Слайд 9
2. Восстановительные свойства.
4HCl + MnO2 → MnCl2 +
Cl2 + 2H2O
16HCl + 2KMnO4 → 2MnCl2 + 5Cl2
+ + 2KCl + 8H2O
6HCl + KClO3 → 3Cl2 + KCl + 3H2O





























