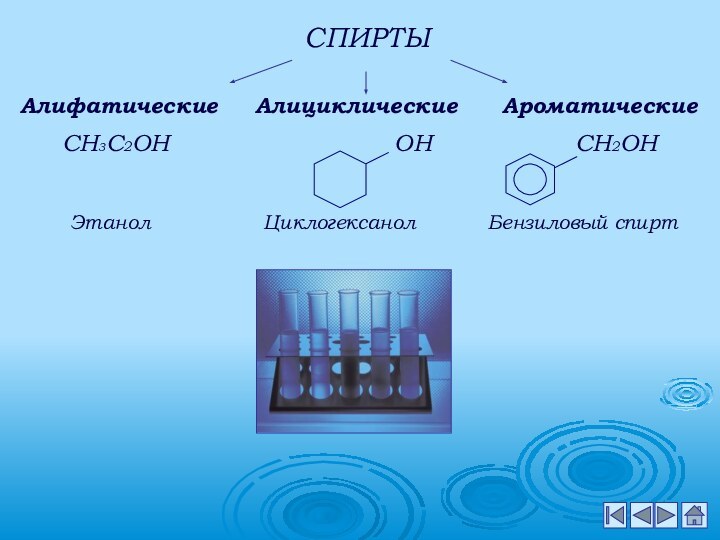
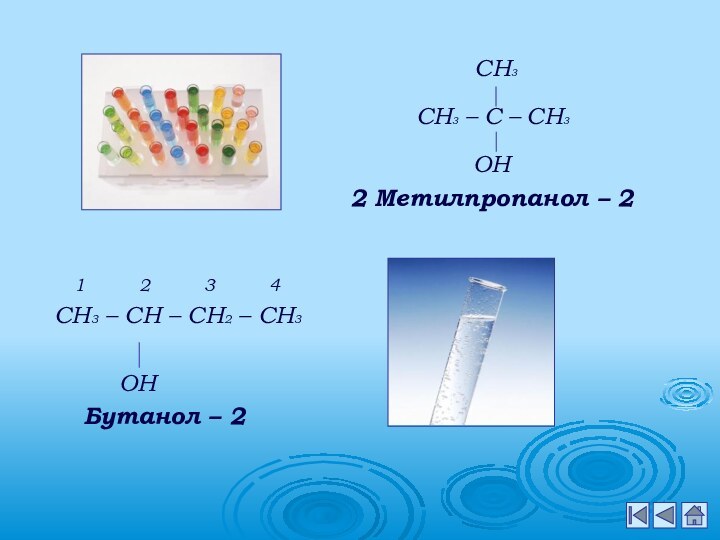
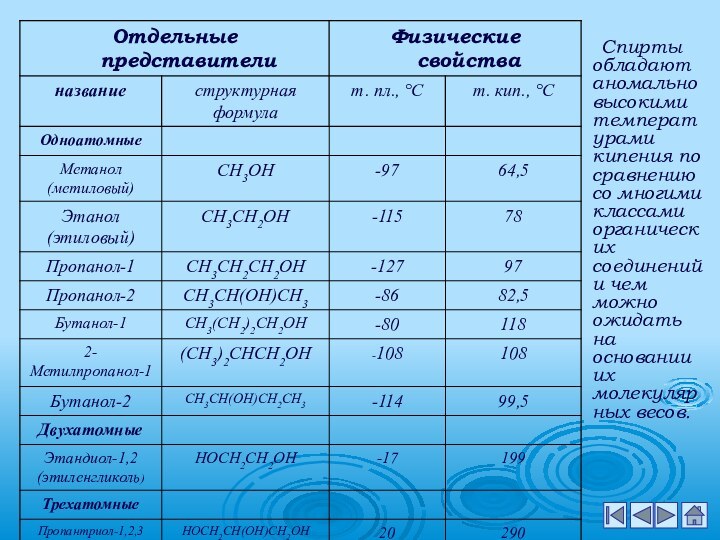
металлами;
Замещение гидроксильной группы спирта галогеном;
Дегидратация спиртов (отщепление
воды);Образование сложных эфиров спиртов;
Дегидрогенизация спиртов и окисление;
Методы получения спиртов
Производство этилового спирта;
Процесс получения метилового спирта;
Методы получения других спиртов;
Применение спиртов
Заключение