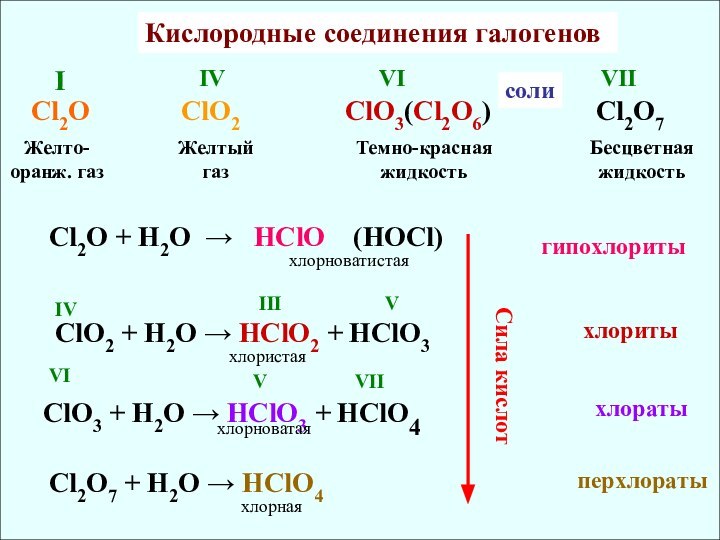
ClO2
ClO3(Cl2O6) Cl2O7Желто-оранж. газ
Желтый газ
Темно-красная жидкость
IV
VI
I
VII
Бесцветная жидкость
Cl2O + H2O → HClO (HOCl)
ClO2 + H2O → HClO2 + HClO3
ClO3 + H2O → HClO3 + HClO4
Cl2O7 + H2O → HClO4
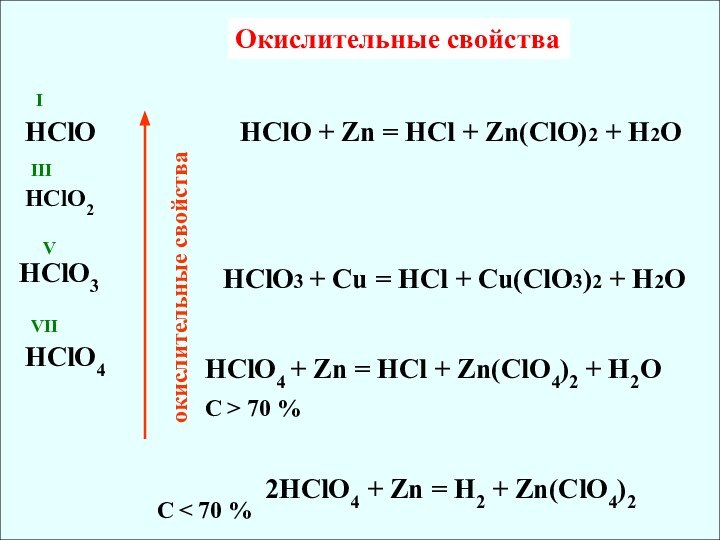
IV
III
V
VI
V
VII
хлорноватистая
хлористая
хлорноватая
хлорная
соли
хлориты
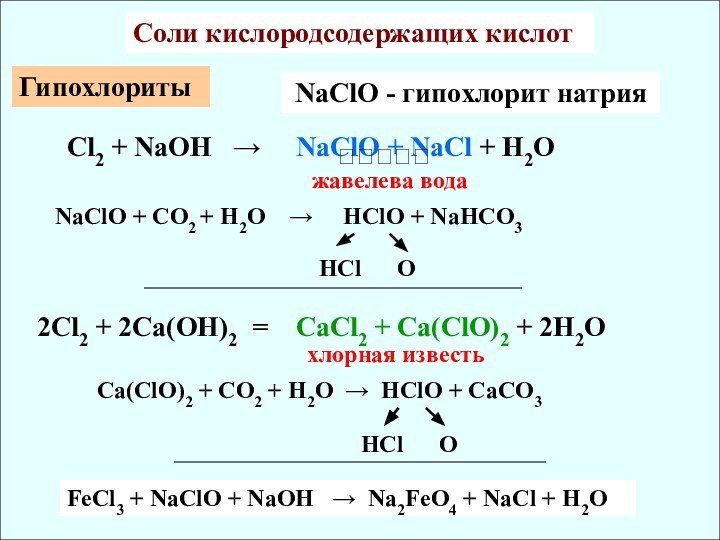
гипохлориты
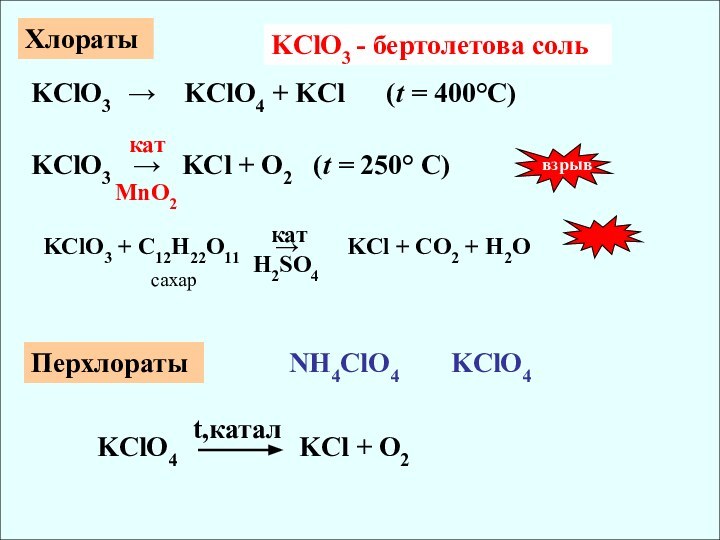
хлораты
перхлораты
Сила кислот





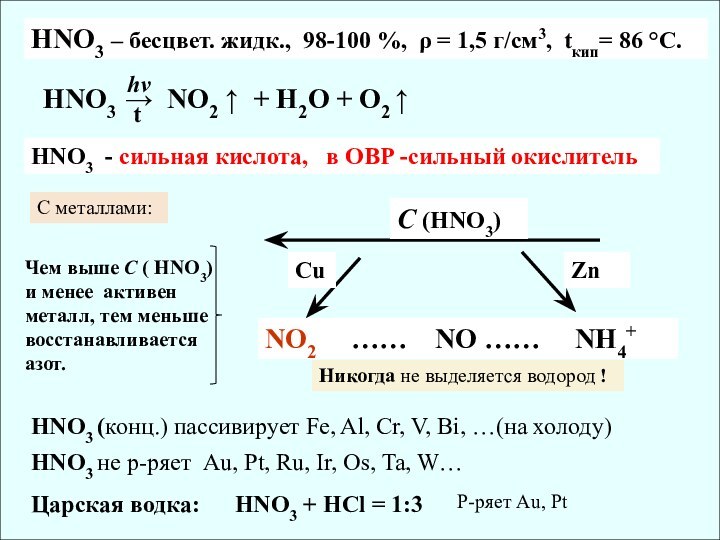
![Химия неметаллов. Общая характеристика Au + HNO3 + HCl → H[AuCl4] + NO + H2O](/img/tmb/11/1095181/6aed979e8f7b011989a35c0004165551-720x.jpg)






























