смеси парафинов (парафин, церезин, вазелин),
битумы,
электродный кокс,
растворители,
индивидуальные парафиновые, олефиновые (алкены) углеводороды
ароматические углеводороды.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть




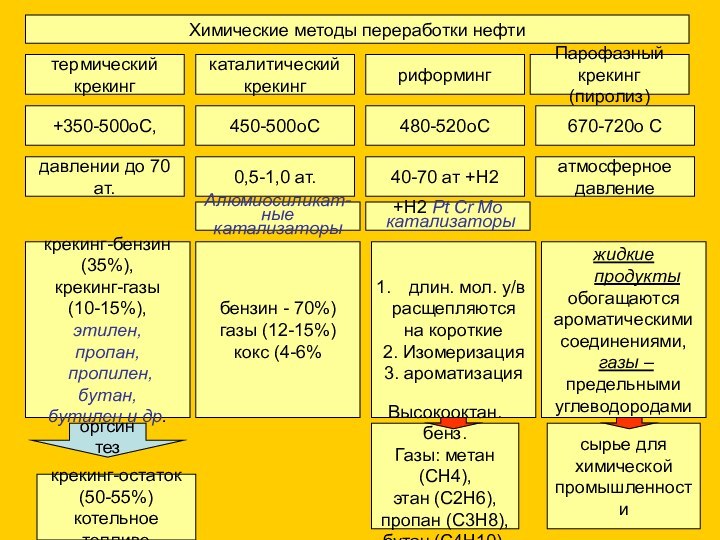



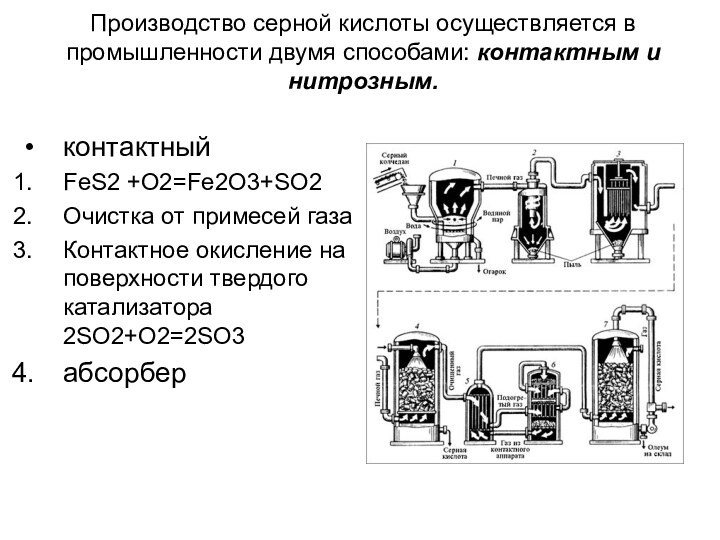
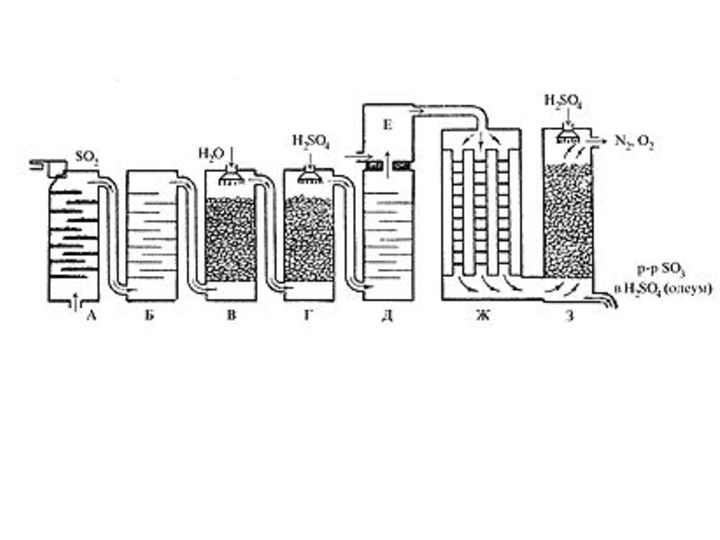


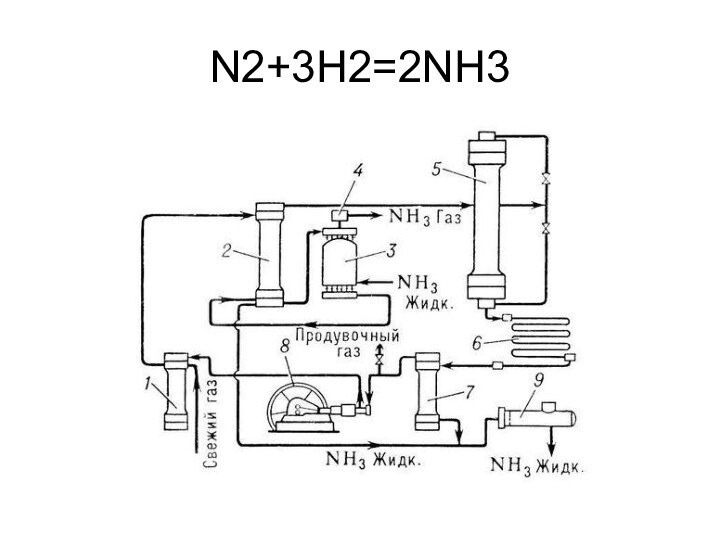

















давлении до 70 ат.
0,5-1,0 ат.
40-70 ат +H2
атмосферное
давление
крекинг-остаток
(50-55%)
котельное топливо
оргсинтез
Алюмиосиликат-
ные катализаторы
бензин - 70%)
газы (12-15%)
кокс (4-6%
длин. мол. у/в
расщепляются
на короткие
2. Изомеризация
3. ароматизация
+H2 Pt Cr Mo
катализаторы
Высокооктан. бенз.
Газы: метан (СН4),
этан (С2Н6),
пропан (С3Н8),
бутан (С4Н10).
жидкие продукты
обогащаются
ароматическими
соединениями,
газы –
предельными
углеводородами
сырье для
химической
промышленности
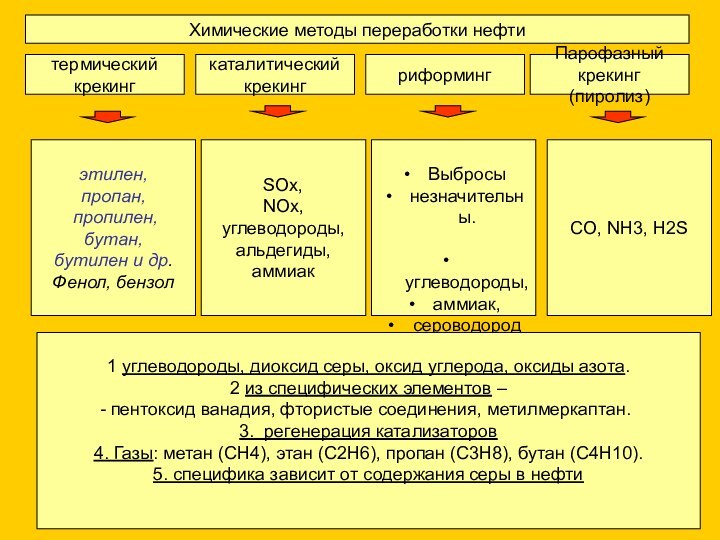
SOx,
NOx,
углеводороды,
альдегиды,
аммиак
Выбросы
незначительны.
углеводороды,
аммиак,
сероводород
1 углеводороды, диоксид серы, оксид углерода, оксиды азота.
2 из специфических элементов –
пентоксид ванадия, фтористые соединения, метилмеркаптан.
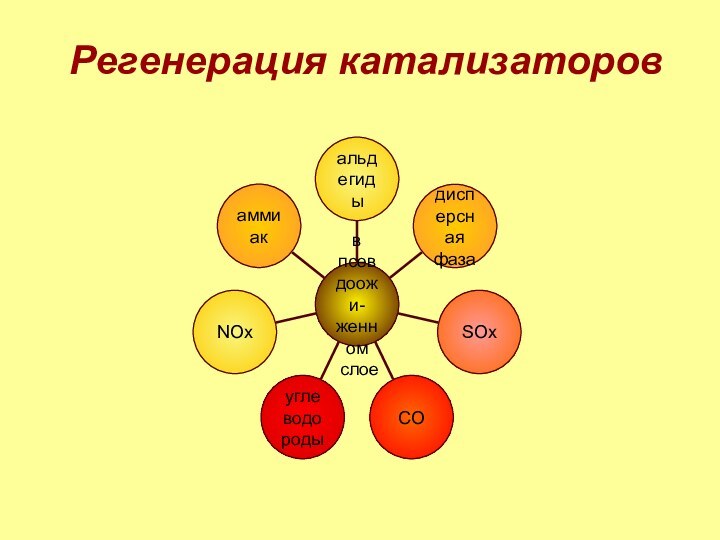
3. регенерация катализаторов
4. Газы: метан (СН4), этан (С2Н6), пропан (С3Н8), бутан (С4Н10).
5. специфика зависит от содержания серы в нефти
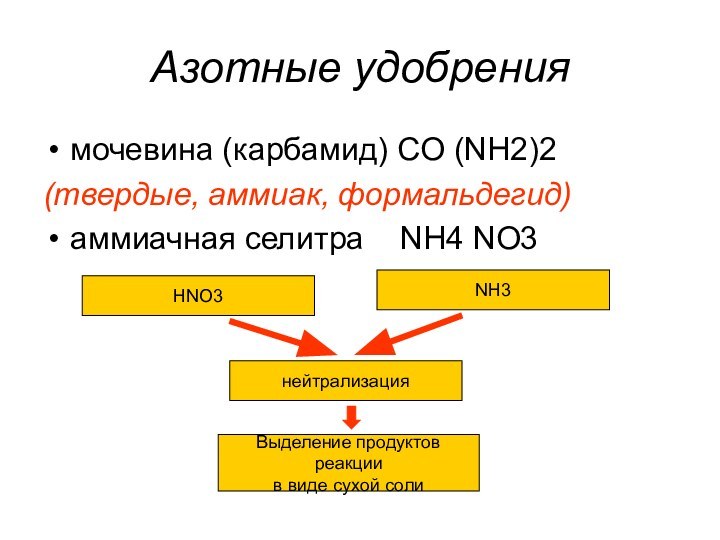
CO, NH3, H2S
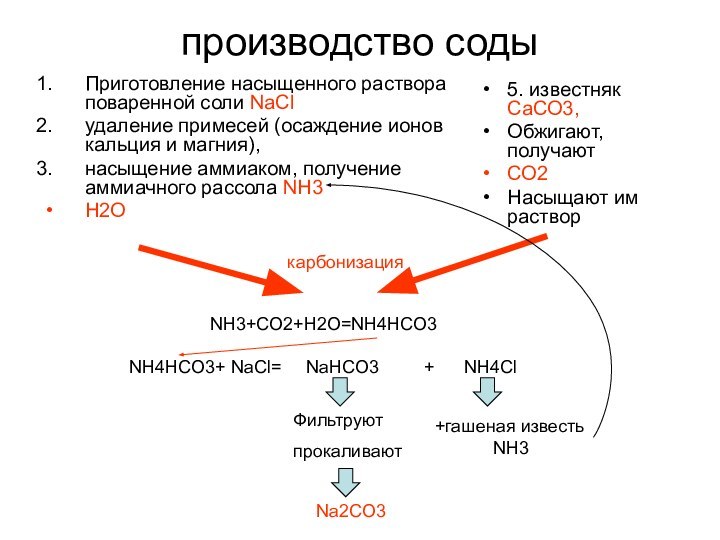
5. известняк СаСО3,
Обжигают, получают
СО2
Насыщают им раствор
карбонизация
NH3+CO2+H2O=NH4HCO3
NH4HCO3+ NaCl= NaHCO3 + NH4Cl
Фильтруют
прокаливают
+гашеная известь
NH3
Na2CO3
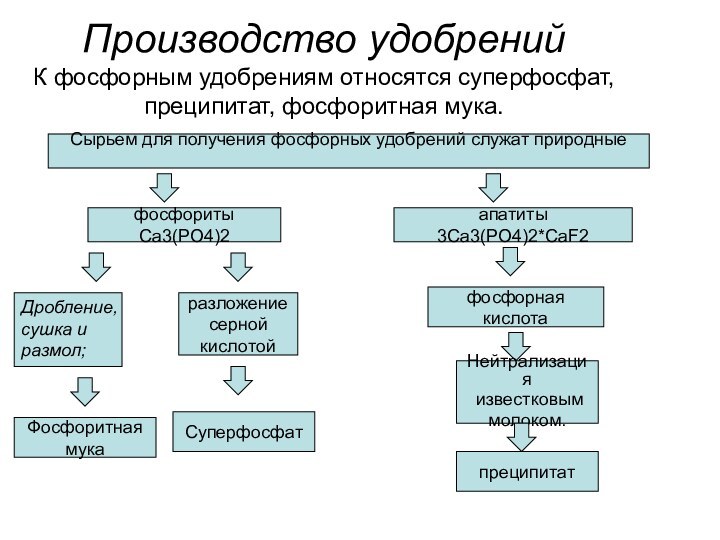
апатиты 3Ca3(PO4)2*CaF2
Дробление,
сушка и
размол;
Фосфоритная
мука
разложение
серной
кислотой
Суперфосфат
фосфорная кислота
Нейтрализация
известковым
молоком.
преципитат
1 прессование,
2 дробление,
3 сортировка
4 транспортировка.