Mo: […] 5s1 4d 55p0
W: […] 6s 2
4f 145d 46p0 Ст. окисления: 0, +II, +III, +IV, +VI (Cr); 0, +IV, +VI (Mo, W)
Валентность (КЧ): Cr 6; Mo 6, 8; W 6, 8, 9;
Cr, Mo:
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть

![Химия элементов Электронное строение Cr: […] 4s1 3d 5 4p0 Mo: […] 5s1 4d](/img/tmb/13/1276281/7fac0d8eac1912a428e32dae2f214445-720x.jpg)

![Химия элементов Простые веществаCr + 2H3O+ + 4H2O = [Cr(H2O)6]2+ + H2Mo(W) + H3O+ ](/img/tmb/13/1276281/52403b01359ce617dafb62762a8e4064-720x.jpg)


![Химия элементов Комплексные соединенияСт. ок. 0: [Э0(CO)6][Cr0(CO)6] – гексакарбонилхром: диамагнитный d 2sp3, октаэдр[Cr+ (CO–/6)6]](/img/tmb/13/1276281/2267b7144732b614b0cb3dfd33312e38-720x.jpg)
![Химия элементов Комплексные соединения CrIII[Cr(H2O)4Cl2]Cl · 2H2O зеленый[Cr(H2O)6]Cl3 фиолетовый CrCl3 · 6H2O[Cr(H2O)4Cl2]+ + 2](/img/tmb/13/1276281/7e6baf83af27e83c1b0cfa4f8dea9198-720x.jpg)

![Химия элементов Пероксокомплексы Cr2O72 + 4H2O2 + 2H3O+ + L = = 2[CrVI(L)O(O22)2] +](/img/tmb/13/1276281/54b0f820a3c2076f5478ec25e64463ca-720x.jpg)




![Химия элементов Аквакатион хрома(II)Сильнейший восст-ль: (Cr3+/Cr2+) = –0,41 В4[CrII(H2O)6]2+ + O2 + 4H3O+](/img/tmb/13/1276281/e3a59ce8f2b28f8545dc0cbd63368e04-720x.jpg)

![Химия элементов [Cr(H2O)6]3+ + 3NH3·H2O Cr2O3·nH2O(т) + …](/img/tmb/13/1276281/e1ad11f480cffe89cf05e23ff1a0e8a7-720x.jpg)
![Химия элементов Окислительно-восстановительные свойстварН < 7: Cr2O72 + 14H3O+ + 6e = 2[Cr(H2O)6]3+ +](/img/tmb/13/1276281/2bf981360dfc29371ba5f49c85ccb651-720x.jpg)


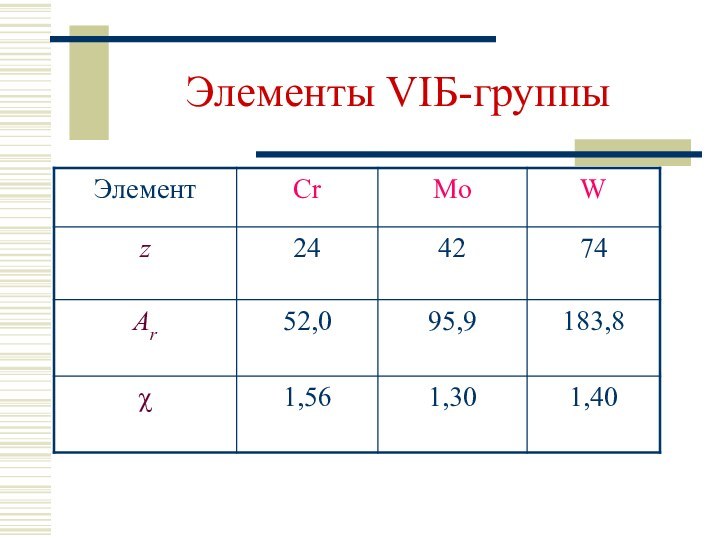
Ст. окисления: 0, +II, +III, +IV, +VI (Cr); 0, +IV, +VI (Mo, W)
Валентность (КЧ): Cr 6; Mo 6, 8; W 6, 8, 9;
Cr, Mo:
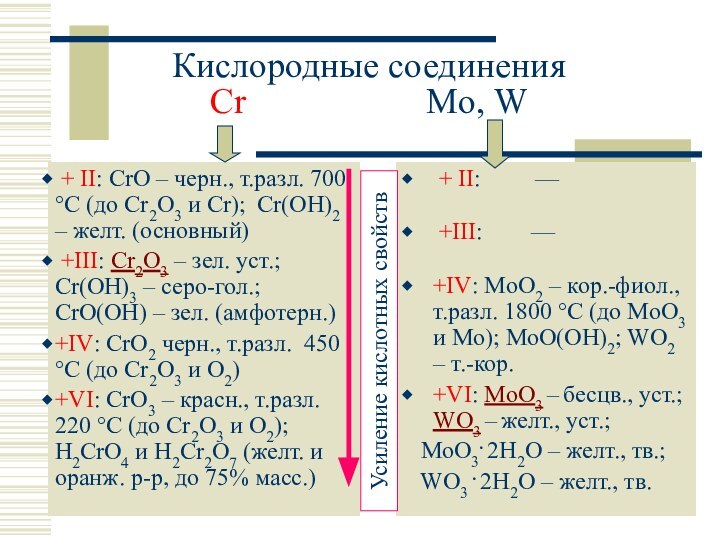
+ II: —
+III: —
+IV: MoO2 – кор.-фиол., т.разл. 1800 C (до MoO3 и Mo); MoO(OH)2; WO2 – т.-кор.
+VI: MoO3 – бесцв., уст.; WO3 – желт., уст.;
MoO3. 2H2O – желт., тв.;
WO3 . 2H2O – желт., тв.
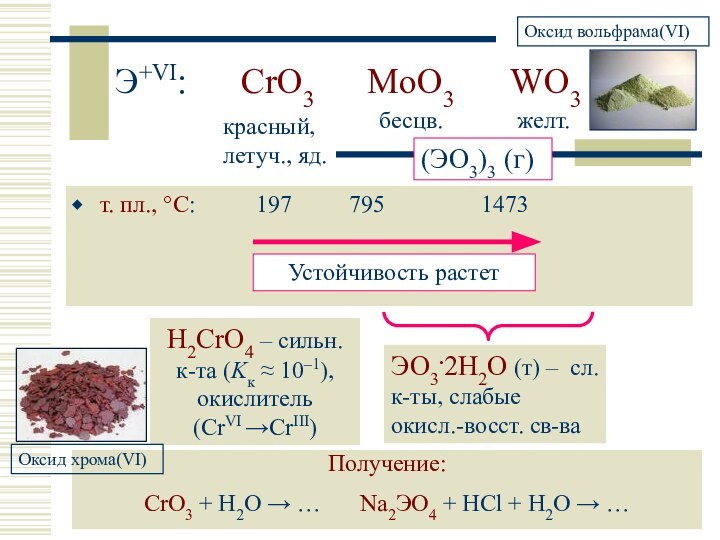
красный, летуч., яд.
бесцв.
желт.
(ЭO3)3 (г)
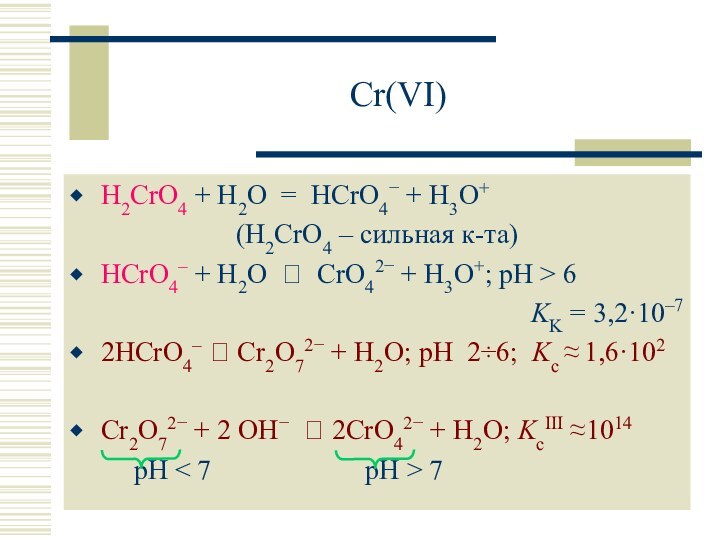
H2CrO4 – сильн. к-та (Kк 10–1), окислитель (CrVI CrIII)
Получение:
CrO3 + H2O … Na2ЭO4 + HCl + H2O …
[Cr(H2O)6]3+ + H2O [Cr(H2O)5OH]2+ + H3O+;
KK = 1,12 · 10–4
2[Cr(H2O)5OH]2+ [(H2O)5Cr(OH)2Cr(H2O)5]4+
Cr(OH)3, CrO(OH) – зелен. крист.
[Cr(H2O)6]3+ фиолет. (рН < 5)
[Cr(OH)6]3– зелен.(рН > 11)
d 2sp3 – октаэдр., парамагн.