1) NaOH + HCl → NaCl + H2O;
2) H2 + I2 → 2HI;
3) C + O2 → CO2;
4) CaCO3 + 2HCl → CaCl2 + CO2 + H2O.
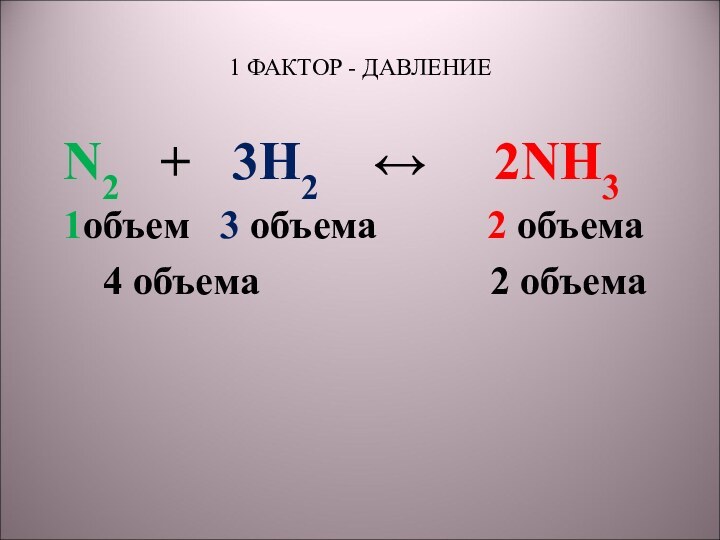
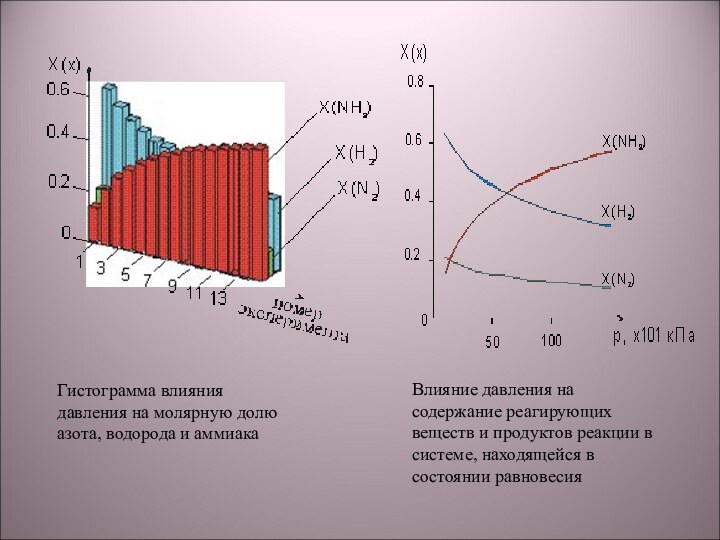
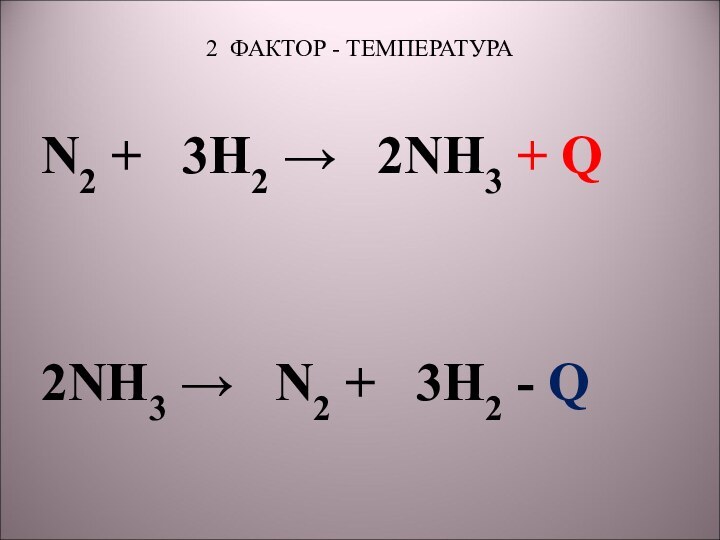
5) N2 + 3H2 → 2NH3
6) С6Н12 → С6Н6 + 3Н2
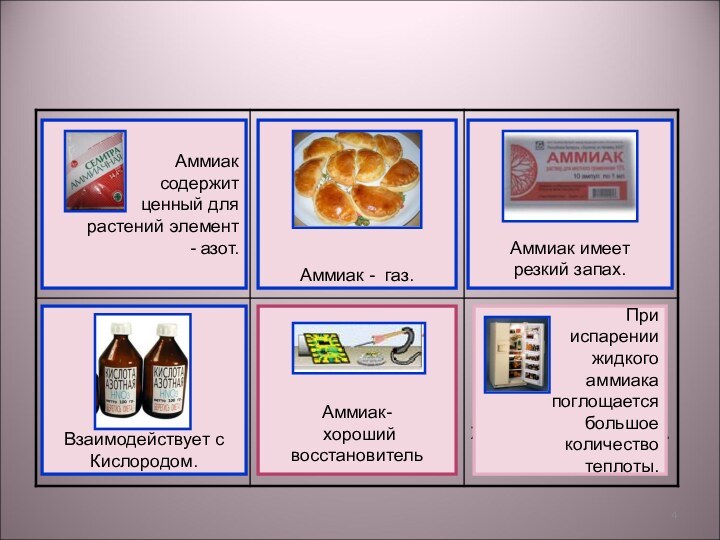
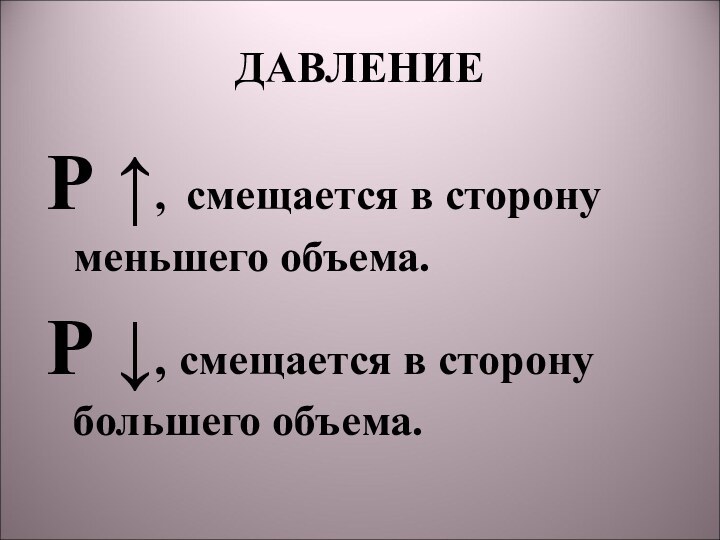
Обратимые реакции
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть


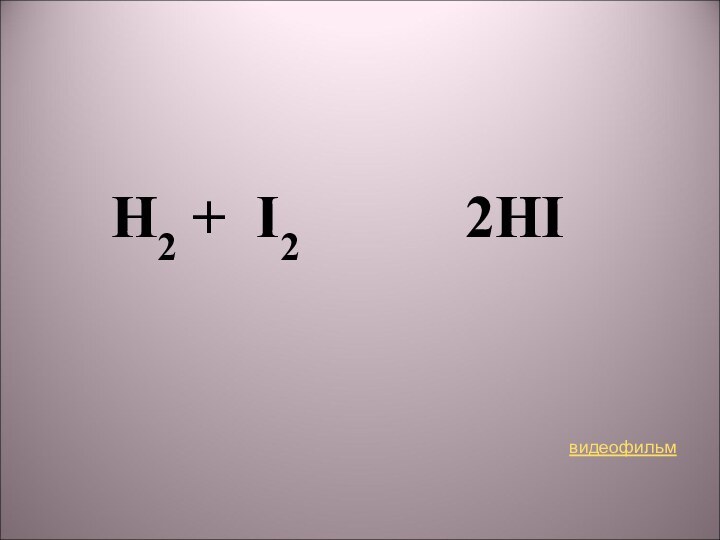
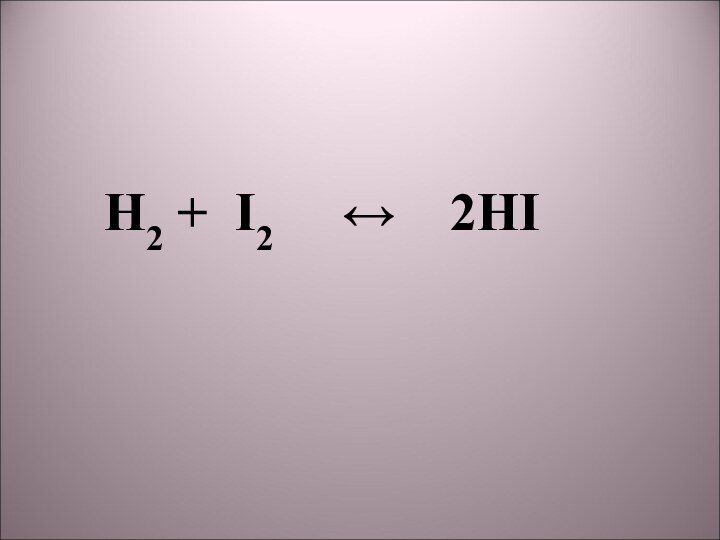
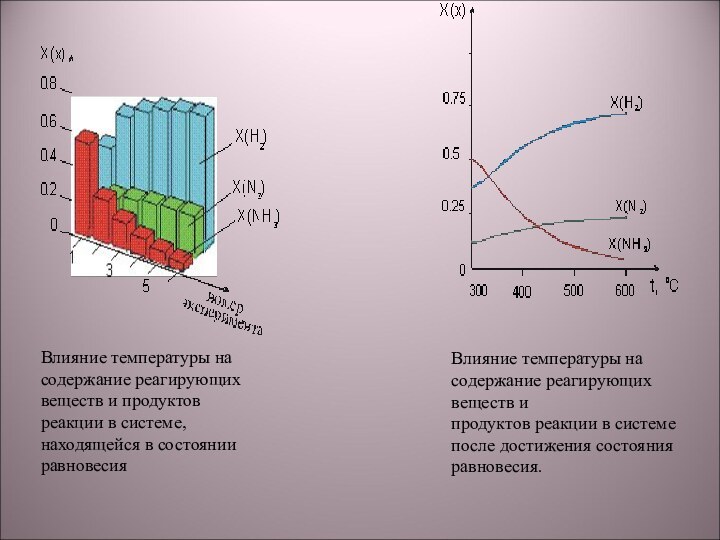











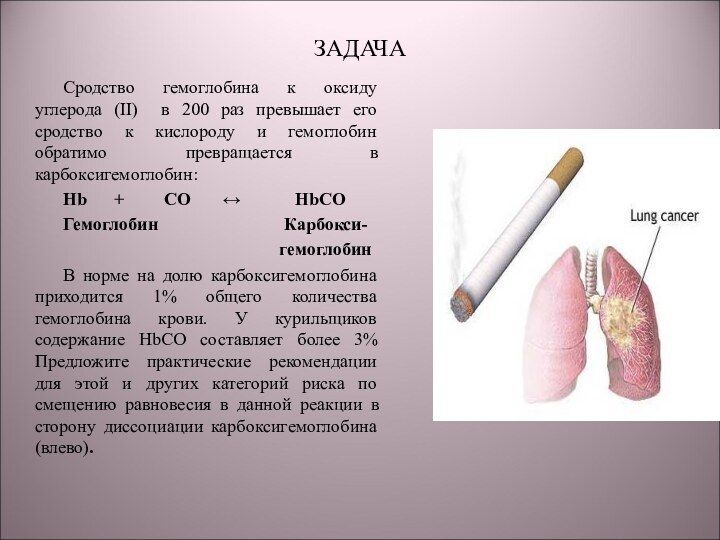



1) NaOH + HCl → NaCl + H2O;
2) H2 + I2 → 2HI;
3) C + O2 → CO2;
4) CaCO3 + 2HCl → CaCl2 + CO2 + H2O.
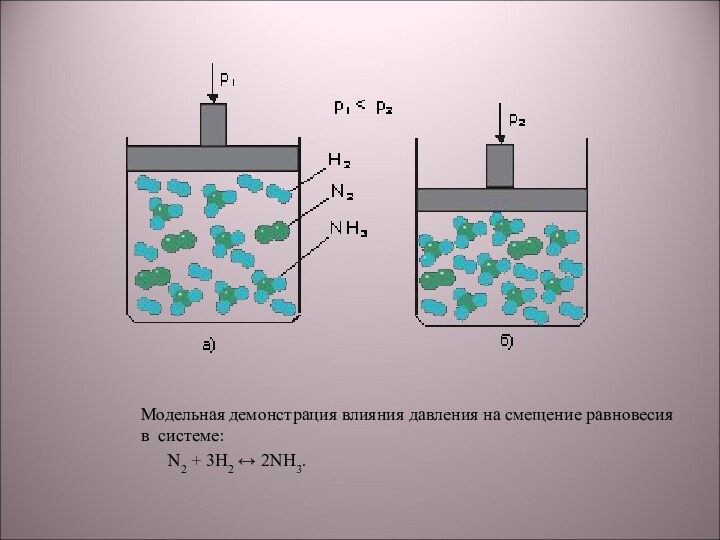
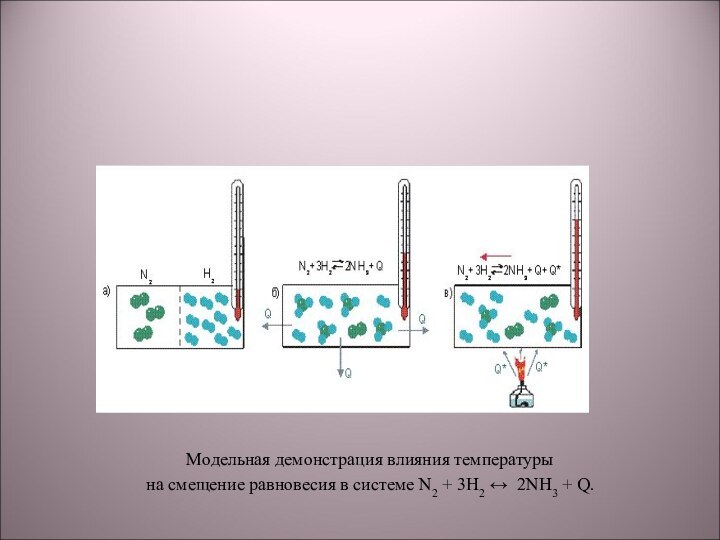
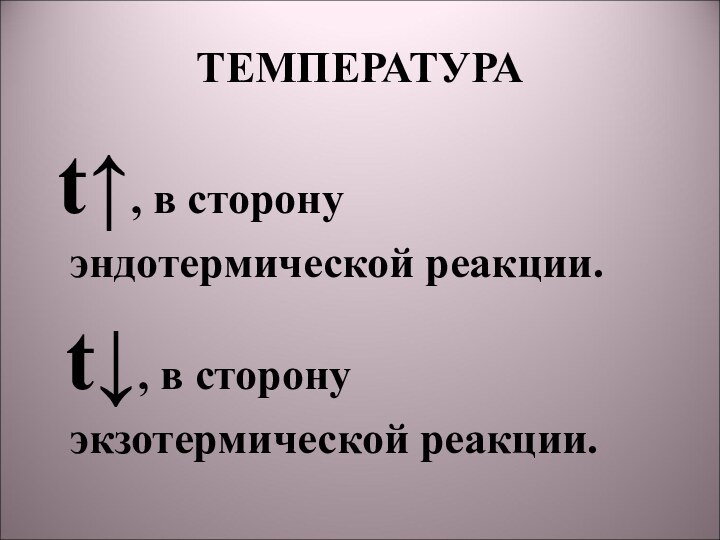
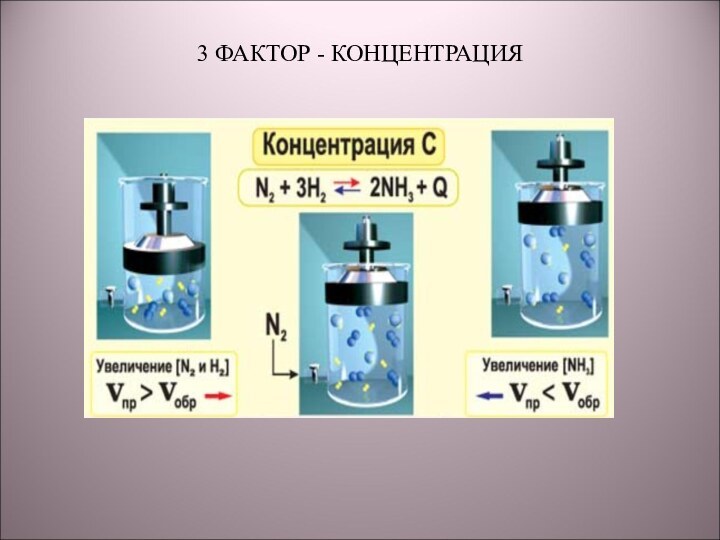
5) N2 + 3H2 → 2NH3
6) С6Н12 → С6Н6 + 3Н2
Обратимые реакции
КАТАЛИЗАТОРЫ В РАВНОЙ СТЕПЕНИ УСКОРЯЮТ И ПРЯМУЮ И ОБРАТНУЮ , ИЗМЕНЯЯ ЭНЕРГИЮ АКТИВАЦИИ И ТОЙ И ДРУГОЙ НА ОДНУ И ТУЖЕ ВЕЛИЧИНУ