- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химическая связь 11 класс
Содержание
- 2. Цель урока обобщить и систематизировать знания
- 3. План изучения темы урокаПонятие «химическая связь».Ионная химическая связь:механизм образования;характеристики связи;ионная кристаллическая решетка.
- 4. Что такое химическая связь?
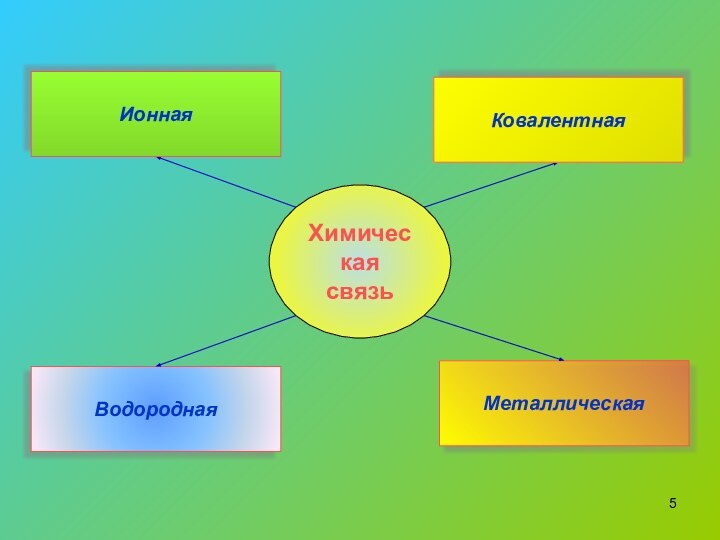
- 5. Химическая связьВодороднаяМеталлическаяКовалентнаяИонная
- 6. Электроотрицательность- способность атомов одних химических элементов притягивать
- 7. 2. Ионная химическая связь - связь, образующаяся
- 8. Механизм образования ионной связи1s22s22p63s11s2s3s2p1s2s3s2p3p1s22s22p63s23p5Na0 – 1e- =Cl20
- 9. Запомни!!!полного перехода электронов при образовании ионной химической
- 10. Электроотрицательность- способность атомов одних химических элементов притягивать
- 11. по составупо зарядупростые:Na+, Ca2+, Cl-сложные:OH-, SO42-, No3-положительные: Ca2+, Na+Ионыотрицательные:OH-, SO42-
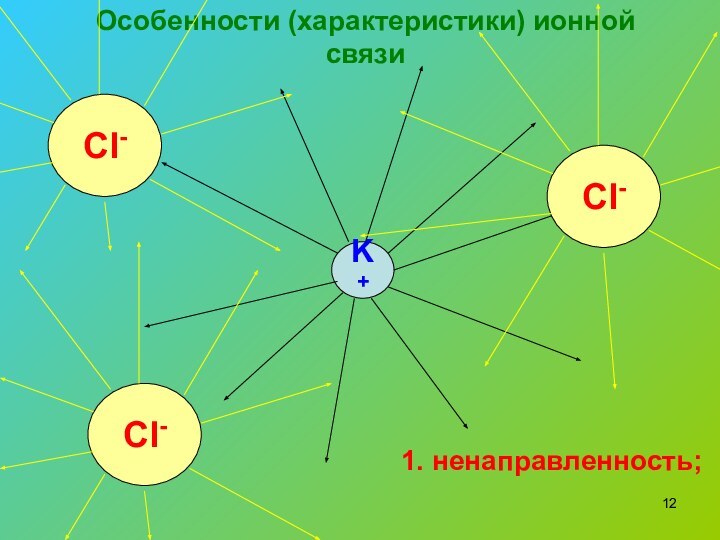
- 12. Особенности (характеристики) ионной связиK+Cl-Cl-Cl-1. ненаправленность;
- 13. Особенности (характеристики) ионной связи2. ненасыщаемость.Кристаллическая решетка ионных
- 14. Домашнее задание§6 (стр. 44-46), упр. 4 на
- 15. Скачать презентацию
- 16. Похожие презентации
Цель урока обобщить и систематизировать знания о видах химической связи и их классификации как о важнейшем универсальном понятии теоретической химии









Слайд 3
План изучения темы урока
Понятие «химическая связь».
Ионная химическая связь:
механизм
образования;
характеристики связи;
ионная кристаллическая решетка.
Слайд 6
Электроотрицательность
- способность атомов одних химических элементов притягивать электроны
в соединениях от атомов других химических элементов
Δ א –
разница электроотрицательностей:Δ א > 1,7 – ионная химическая связь;
0 < Δא < 1,7 – ковалентная химическая связь
Слайд 7
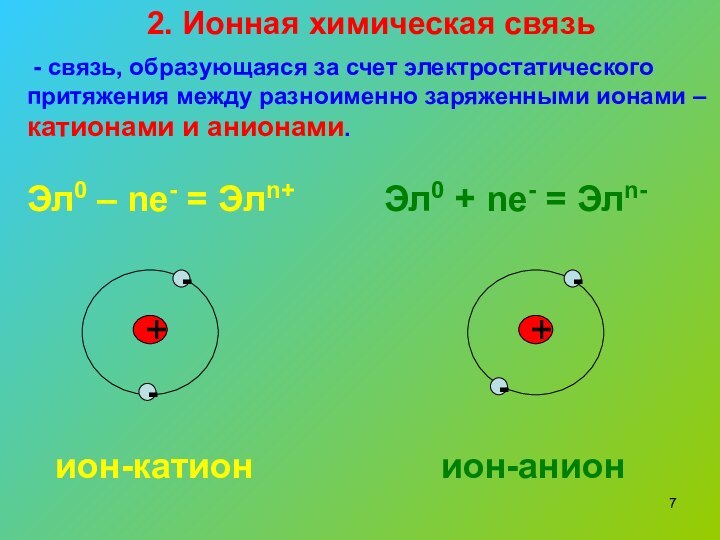
2. Ионная химическая связь
- связь, образующаяся за
счет электростатического притяжения между разноименно заряженными ионами – катионами
и анионами.Эл0 – nе- = Элn+
Эл0 + nе- = Элn-
+
-
-
+
-
ион-катион
-
ион-анион
Слайд 8
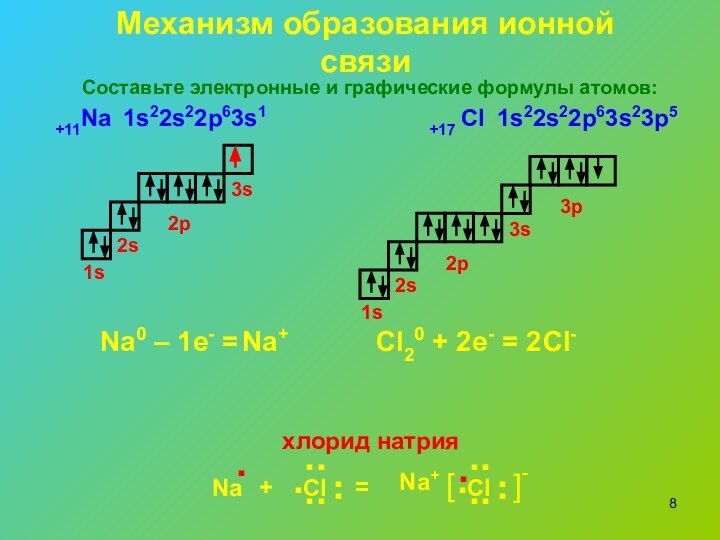
Механизм образования ионной связи
1s22s22p63s1
1s
2s
3s
2p
1s
2s
3s
2p
3p
1s22s22p63s23p5
Na0 – 1e- =
Cl20 +
2e- = 2
Na+
Cl-
хлорид натрия
Na
.
+
Cl
.
.
.
.
.
.
.
=
Na+
Cl
.
.
.
.
.
.
.
[
-[
.
+11Na
+17 Cl
Составьте электронные и графические формулы
атомов:
Слайд 9
Запомни!!!
полного перехода электронов при образовании ионной химической связи
не происходит. Об этом свидетельствуют величины эффективных зарядов в
соединениях
Слайд 10
Электроотрицательность
- способность атомов одних химических элементов притягивать электроны
в соединениях от атомов других химических элементов
Δ א –
разница электроотрицательностей:Δ א > 1,7 – ионная химическая связь;
Например, NaCl
א(Na) = 1,01;
א (Cl) = 2,83;
Δ א = 2,83 – 1,01 = 1,82, т.е. ионная химическая связь
Слайд 11
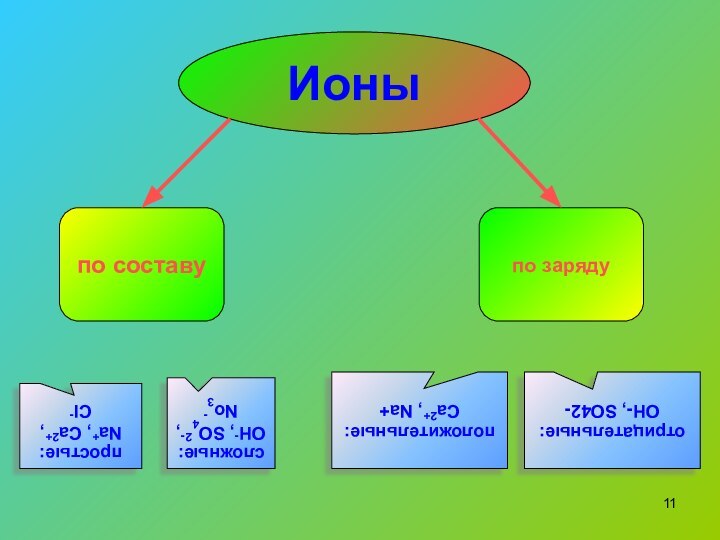
по составу
по заряду
простые:
Na+, Ca2+, Cl-
сложные:
OH-, SO42-, No3-
положительные: Ca2+,
Na+
Ионы
отрицательные:
OH-, SO42-
Слайд 13
Особенности (характеристики) ионной связи
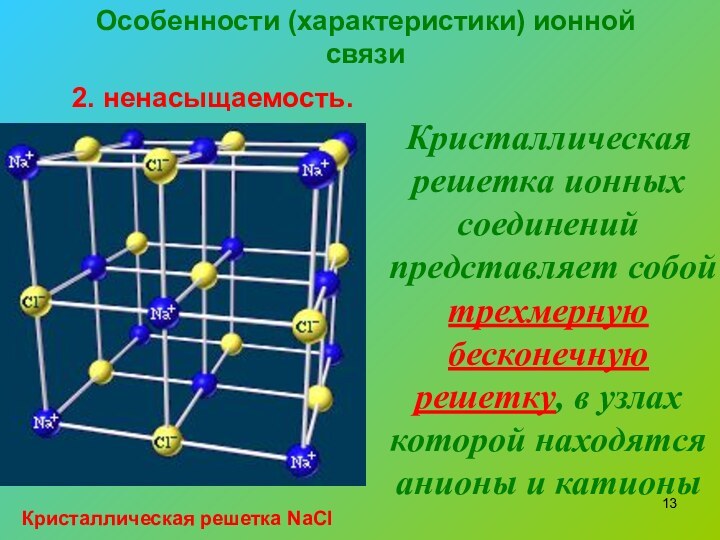
2. ненасыщаемость.
Кристаллическая решетка ионных соединений
представляет собой трехмерную бесконечную решетку, в узлах которой находятся
анионы и катионыКристаллическая решетка NaCl
Слайд 14
Домашнее задание
§6 (стр. 44-46), упр. 4 на стр.
56, распишите механизм образования ионной связи в молекулах:
1 вариант
- хлорида кальция;2 вариант – бромида калия;
3 вариант – нитриде натрия.





























