Слайд 2
Элементы с неметаллическими свойствами находятся в IIIA-VIIA -
группах Периодической системы:
III IV
V VI VII
B С N O F
Si P S CI
As Se Br
Te I
At
Слайд 3
Общая электронная
формула атомов неметаллов ns2np1−5,
Слайд 4
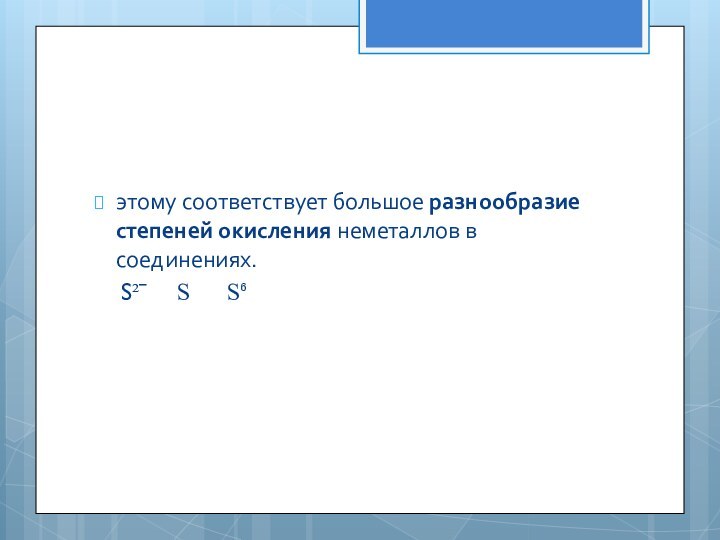
этому соответствует большое разнообразие степеней окисления неметаллов в соединениях.
S²ˉ S S⁶
Слайд 5
Характерной особенностью неметаллов является большее (по сравнению с
металлами) число электронов на внешнем энергетическом уровне их атомов.
Это определяет их большую способность к присоединению дополнительных электронов и проявлению высокой окислительной активности.
Слайд 6
Вот почему значения электроотрицательности у них велики. Отсюда многообразие в
химических свойствах и способах получения неметаллов.
Слайд 7
Другая характерная особенность неметаллов - стремление образовывать ковалентные связи с
атомами других неметаллов и амфотерных элементов. Поэтому и простые
вещества и соединения неметаллов имеют ковалентное строение.
Слайд 8
В свободном виде встречаются
-газообразные вещества - F2, Cl2, O2,
N2 Н2,
-твердые - I2, At, S, Te, P, As, C, Si
и В,
-при комнатной температуре известен один жидкий неметалл - бром Br2.
Слайд 9
Нередко для неметаллов наблюдается аллотропия,
-кислорода (О2 и О3)
-углерода
(графит, алмаз, карбин, фуллерен)
-Фосфор (белый, красный, черный)
- Сера (ромбическая,
моноклинная, пластическая)
Слайд 10
В природе встречаются самородные неметаллы - N2 и O2 (в воздухе),
сера
(в земной коре),
но чаще неметаллы в природе находятся
в химически связанном виде.
Слайд 11
это вода и растворенные в ней соли,
затем - минералы и горные породы (например, различные силикаты, алюмосиликаты,
фосфаты, бораты, сульфаты и
карбонаты).
Слайд 12
По распространенности в земной коре неметаллы занимают самые
различные места: от трех самых распространенных элементов (O, Si,
H) до весьма редких (As, Se, I, Te).
Слайд 13
Гораздо богаче у неметаллов и спектр цветов: красный
– у фосфора,
красно-бурый – у брома,
желтый – у серы,
желто-зеленый – у хлора, фиолетовый – у паров йода.
Слайд 14
Физические свойства неметаллов.
Ковкость отсутствует
Блеска нет
Теплопроводность (только графит)
Цвет разнообразный:
желтый, желтовато-зеленый, красно-бурый.
Электропроводность (только графит и черный Фосфор.)
Агрегатное состояние:
газообразное(H2,
O2, Cl2 ,F2, O3)
твердое (Р, С)
жидкое (Br2)
Слайд 15
Химические свойства неметаллов.
Неметаллы в химических реакциях могут быть
восстановителями и окислителями (кроме фтора, кислорода.)
Слайд 16
Водородные соединения неметаллов.
В отличие от металлов неметаллы образуют
газообразные водородные соединения. Их состав зависит от степени окисления
неметаллов
-4 -3 -2 -1
RH4 → RH3 → H2R → HR
Слайд 17
летучие водородные соединения неметаллов можно разделить на три
группы:
1) Хорошо растворимые в воде
(HCl, HBr, HJ, H2S,
H2Se, NH3),
которые диссоциируют на ионы, проявляя кислотные и основные свойства.
Слайд 18
2) Соединения, разлагаемые водой:
BH3 + 3H2O = H3BO3 + 3H2↑
Слайд 19
3) Летучие водородные соединения
CH4, PH3, которые не взаимодействуют
с водой.
Слайд 20
В группе с увеличением заряда ядра кислотные свойства
и восстановительные свойства водородных соединений неметаллов увеличиваются:
Слайд 21
По периоду в ПСХЭ Д. И. Менделеева с
увеличением порядкового номера элемента – неметалла усиливается кислотный характер
водородного соединения.
SiH4 → PH3 → H2S → HCl
Слайд 22
Кислородные соединения неметаллов
проявляют кислотные свойства.
Неметаллы при взаимодействии с кислородом
(прямом или косвенном) обра- зуют кислотные оксиды, гидроксиды которых проявляют кислотные свойства:
Слайд 23
НеМе (Э) → кислотный оксид (ЭхОу) → гидроксид
– кислота (НхЭОу)
S + O2= SO2;
SO2 + H2O
= H2SO3
SO2 + Na2O = Na2SO3;
SO2 + 2NaOH = Na2SO3 + H2O
Слайд 24
Кислотные свойства оксидов и гидроксидов в периоде увеличиваются,
а группе уменьшаются.:
SiO2 – P2O5 – SO3 –
Cl2O7
H2SiO3 – H3PO4 – H2SO4 – HClO4
Кислотные свойства увеличиваются
НNО3 – H3PO4 – H3 АsO4
Кислотные свойства уменьшаются
Слайд 25
Если неметалл может образовывать соединения с разными степенями
окисления, то свойства соединений будут зависеть от степени окисления
элемента. С увеличением степени окисления кислотные свойства соединений увеличиваются:
НСIО – НСIО2 – НСIО3 – НСIО4
H2S– H2SO3 – H2SO4
Кислотные свойства усиливаются
Слайд 26
В периодической таблице металлические элементы отделены от неметаллических
элементов диагональной линией, проходящей от бора к астату.
Слайд 27
Вдоль этой границы располагаются элементы, проявляющие свойства металлов
и неметаллов. К ним относятся бор, кремний, германий мышьяк,
сурьма, теллур и астат, которые называются полуметаллами или металлоиды.
Слайд 28
Таким образом, внутри каждого периода имеется «пограничная зона»,
в которой располагается элемент, проявляющий двойственные свойства. Следовательно, переход
от типичного металла к типичному неметаллу в периоде происходит постепенно. Внутри больших периодов переход от металлов к неметаллам происходит плавно.
Слайд 29
Следовательно, переход от типичного металла к типичному неметаллу
в периоде происходит постепенно. Внутри больших периодов переход от
металлов к неметаллам происходит плавно.
Слайд 30
Выводы
1. Элементы-неметаллы расположены в главных подгруппах III–VIII групп
ПС Д.И. Менделеева, занимая её верхний правый угол.
2. На
внешнем электронном слое атомов элементов-неметаллов находятся от 3 до 8 электронов.
3. Неметаллические свойства элементов усиливаются в периодах и ослабевают в подгруппах с увеличением порядкового номера элемента.
4. Высшие кислородные соединения неметаллов имеют кислотный характер (кислотные оксиды и гидроксиды).
5. Атомы элементов-неметаллов способны как принимать электроны, проявляя окислительные функции, так и отдавать их, проявляя восстановительные функции.
6.У неметаллов радиус атомов меньше чем у металлов
Слайд 31
Биологическая роль химических элементов в организме человека
Основу живых
систем составляют только шесть элементов: углерод, водород, кислород, азот,
фосфор, сера.
Слайд 32
углерод, водород, кислород, азот, фосфор и сера относятся
к макроэлементам, т.е. элементам, содержание которых в организме выше
10-2 %.
Слайд 33
К микроэлементам, содержание которых в организме находится в
пределах от
10-3 до10-5 %, из неметаллов относятся иод,
мышьяк, фтор, бром.
Слайд 34
По значимости для жизнедеятельности элементы делятся на группы.
К жизненно необходимым или незаменимым элементам относится ряд металлов
(Ca, K, Na, Mg, Mn, Cu, Co, Fe, Zn, Mo, V) и следующие неметаллы: Н, О, N, P, S, Cl, C, I.
Слайд 35
Кроме того, в организме человека постоянно находятся следующие
неме- таллы: Br, F, B, Si, As, Se. Элементы,
необходимые для построения и жизне- деятельности различных клеток и организмов, называют биогенными эле- ментами.
Слайд 36
Для организма вреден не только недостаток, но и
избыток биогенных эле- ментов. В результате недостатка или избытка
того или иного элемента в ор- ганизме человека могут возникать различные заболевания.
Слайд 37
Закрепление изученного
1) Вставьте слова, пропущенные в тексте.
Атомы ____
в отличие от атомов ____ легко принимают наружные электроны,
являются ____
Слайд 38
2) Вставьте слова , пропущенные в тексте.
Неметаллические свойства
элементов с увеличением порядкового номера в периодах ____
В группах
неметаллические свойства элементов ____
Слайд 39
3) Пользуясь периодической таблицей, запишите молекулярные формулы высших
кислородных соединений неметаллов III периода. Как будет изменяться кислотный
характер?
Слайд 40
4) Запишите формулы водородных соединений элементов VII А
группы. Как изменяются кислотные свойства с увеличением порядкового номера
элемента?
Слайд 41
5) Водород занимает в периодической таблице два места:
в I А группе и в VII А группе.
Запишите молекулярные формулы водородных соединений Na, K, Cl, F.
Слайд 42
6) Какую высшую степень окисления имеют следующие элементы?
Азот
Хлор
Сера
Кремний
Фтор
Слайд 43
7) Определите, окислителем или восстановителем является сера в
следующих реакциях:
H2+S=H2S
2SO2 + O2 → 2SO3
Слайд 44
8) Наиболее ярко выраженные неметаллические свойства проявляет вещество,
образованное из атомов, в которых число электронов во внешнем
электронном слое равно____.
• 4 • 5 • 6 • 7
Слайд 45
9) Наиболее электроотрицательными являются атомы…..
• серы
•
фосфора
• кремния
• хлора
Слайд 46
10) Типичному неметаллу соответствует следующая схема распределения электронов
по электронным слоям:
- 2, 1
- 2, 8, 2
- 2, 8, 7